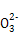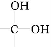题目内容
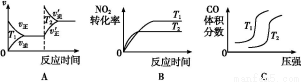
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是( )

A.HA可能为一元弱酸
B.MOH为一元强碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)=0.01 mol·L-1
D
【解析】由图可知,常温下0.01 mol·L-1 HA溶液pH=2,则说明HA为一元强酸,A错;向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液50 mL时,两者恰好反应生成盐,但溶液pH<7,溶液显酸性,故MOH为一元弱碱,B错;溶液中的MOH在K点比N点多了49 mL,c(OH-)大,抑制了水的电离,故N点水的电离程度大于K点,C错;K点溶液的体积为200 mL,根据物料守恒,c(MOH)+c(M+)=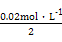 =0.01 mol·L-1,D对。
=0.01 mol·L-1,D对。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
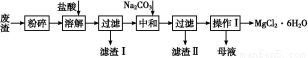
已知:25 ℃时有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。