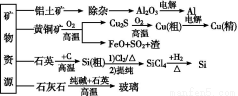
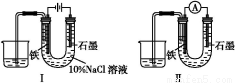
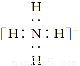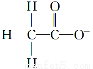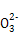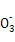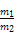ΧβΡΩΡΎ»ί
ΒγΉ”ΙΛ“Β≥Θ”Ο30%ΒΡFeCl3»ή“ΚΗ· ¥Ζσ‘ΎΨχ‘ΒΑε…œΒΡΆ≠≤≠,÷Τ‘λ”ΓΥΔΒγ¬ΖΑεΓΘΡ≥ΙΛ≥Χ ΠΈΣΝΥ¥”Ζœ“Κ÷–ΜΊ ’Ά≠,÷Ί–¬ΜώΒΟFeCl3»ή“Κ,…ηΦΤΝΥœ¬Ν– Β―ι≤Ϋ÷η:

–¥≥ω“ΜΗωΡή÷ΛΟςΜΙ‘≠–‘Fe±»Cu«ΩΒΡάκΉ”ΖΫ≥Χ Ϋ: ΓΘ
ΗΟΖ¥”Π‘Ύ…œΆΦ≤Ϋ÷η ÷–ΖΔ…ζΓΘ«κΗυΨί…œ ωΖ¥”Π…ηΦΤ“ΜΗω‘≠Βγ≥Ί,‘ΎΖΫΩρ÷–Μ≠≥ωΦρ“ΉΉΑ÷ΟΆΦ(±ξ≥ωΒγΦΪΟϊ≥ΤΓΔΒγΦΪ≤ΡΝœΓΔΒγΫβ÷ »ή“Κ)ΓΘ
|
…œ ωΙΐ≥ΧΜΊ ’ΒΡΆ≠ «¥÷Ά≠,ΈΣΝΥΜώΒΟΗϋ¥ΩΒΡΆ≠±Ί–κΫχ––ΒγΫβΨΪΝΕΓΘ–¥≥ωΒγΫβΨΪΝΕ ±―τΦΪ≤ΡΝœΦΑ÷ς“ΣΒΡΒγΦΪΖ¥”Π Ϋ ΓΘ
Fe+Cu2+=Fe2++Cu ΔΌ

¥÷Ά≠,Cu-2e-=Cu2+
ΓΨΫβΈωΓΩΗυΨίΧβΗ…–≈œΔΩ…÷ΣΖœ“Κ”ΠΈΣFeCl3ΓΔCuCl2ΓΔFeCl2ΒΡΜλΚœ»ή“Κ,Φ”»κΒΡ ‘ΦΝaΈΣFe,ΖΔ…ζΖ¥”ΠΈΣ:Fe+2Fe3+=3Fe2+ΓΔFe+Cu2+=Cu+Fe2+,Ψ≠ΔΌΙΐ¬ΥΚσ,¬Υ‘ϋ «Fe”κCuΒΡΜλΚœΈο,‘ΌΦ”»κΙΐΝΩΒΡb(―ΈΥα)ΖΔ…ζΖ¥”Π:Fe+2HCl=FeCl2+H2Γϋ,Ψ≠ΔΎΙΐ¬ΥΚσ¬Υ“Κ÷ς“Σ «FeCl2»ή“Κ,ΫΪΚœ≤ΔΚσΒΡ»ή“Κ÷–Ά®»κc(Cl2),ΖΔ…ζ÷ς“ΣΖ¥”ΠΈΣ:2Fe2++Cl2=2Fe3++2Cl-ΓΘFe+Cu2+=Fe2++CuΩ…“‘÷ΛΟςFe±»CuΜΙ‘≠–‘«Ω,ΗΟΖ¥”Π‘Ύ≤Ϋ÷ηΔΌ÷–ΖΔ…ζΓΘΫΪFe+Cu2+=Fe2++Cu…ηΦΤ≥…‘≠Βγ≥Ί,FeΉςΗΚΦΪ,±»Fe≤ΜΜνΤΟΒΡCuΉς’ΐΦΪΦ¥Ω…,ΒγΫβ÷ »ή“Κ «Κ§Cu2+ΒΡ»ή“ΚΓΘΒγΫβΨΪΝΕΆ≠ ±,¥÷Ά≠Ής―τΦΪ,ΨΪΆ≠Ής“θΦΪΓΘ

 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
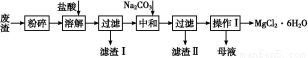
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗΙΛ“Βάϊ”ΟΨΪΝΕΟΨ‘ϋ(Κ§”–MgOΓΔKClΓΔMgCl2ΓΔBaCl2ΓΔCaCl2ΓΔFeCl3Β»‘”÷ )ΜΊ ’MgCl2ΒΡΙΛ“ΒΝς≥Χ»γœ¬:
“―÷Σ:25 Γφ ±”–ΙΊΈο÷ ΒΡ»ήΕ»Μΐ»γœ¬:
Έο÷ | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96ΓΝ10-9 | 6.82ΓΝ10-6 | 5.1ΓΝ10-9 | 5.61ΓΝ10-12 | 2.64ΓΝ10-38 |
ΜΊ¥πœ¬Ν–Έ Χβ:
(1)–¥≥ω»ήΫβ ±ΒΡάκΉ”ΖΫ≥Χ Ϋ ΓΘ
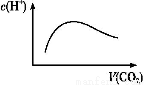
(2)»ήΫβ ±Έ¬Ε»≤ΜΡήΧΪΗΏ,“≤≤Μ“ΥΧΪΒΆ,“Σ«σΩΊ÷Τ‘Ύ35 ΓφΉσ”“,Τδάμ”… « ΓΘ
(3)≤ΌΉςΔώΑϋΚ§ΕύΗω≤ΌΉς,Ζ÷±πΈΣ ,Ιΐ¬Υ,œ¥Β”,ΚφΗ…ΓΘΚφΗ… ±–η“ΣΦθ―ΙΚφΗ…,‘≠“ρ « ΓΘ
(4)ΈΣΦθ…ΌNa2CO3ΒΡ”ΟΝΩΚΆΧαΗΏ≤ζΤΖ÷ ΝΩ,‘Ύ÷–ΚΆΙΛ–ρ(÷–ΚΆΚσ»ή“ΚΫ”Ϋϋ÷––‘)Ϋα χ«Α“ΣΦλ―ι»ή“Κ÷– «Ζώ¥φ‘Ύ άκΉ”,―Γ‘ώΦλ―ιΗΟάκΉ”ΒΡ‘≠“ρ « ΓΘ
(5)ΡΗ“ΚΒΡ÷ς“Σ≥…Ζ÷ ΓΘ