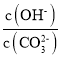题目内容
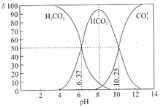
【题目】某温度下,pH相同的盐酸和氯化铵溶液分别稀释,pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
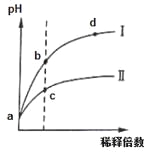
A.Ⅰ为氯化铵稀释时pH值变化曲线,Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比d点溶液中水的电离程度大,但两点的KW相同
C.a点时,等体积的两溶液分别与NaOH反应,消耗的NaOH量相同
D.c点溶液的导电能力一定比b点溶液导电能力强
【答案】D
【解析】
A、盐酸为强酸,氢离子完全电离。氯化铵水解得到氢离子,加水稀释的同时水解程度增大,氢离子浓度变化较小,Ⅰ为盐酸稀释时pH值变化曲线,Ⅱ为氯化铵稀释时pH值变化曲线,故A错误;
B、b、d两点pH均小于7,b点溶液中氢离子浓度大,对水的电离抑制作用强,所以b点水的电离程度比d点溶液中水的电离程度小,B错误;
C、pH相同的盐酸和氯化铵,氯化铵浓度大,等体积的两溶液氯化铵消耗的氢氧化钠多,C错误;
D、c点离子浓度大,导电能力强,D正确。
答案选D。

 名题金卷系列答案
名题金卷系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
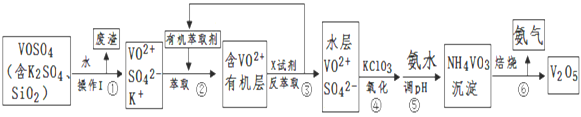
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。