题目内容
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO32-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
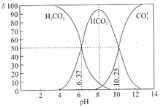
A.当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B.Ka2(H2CO3)的数量级为10-11
C.调节溶液的pH由8~10的过程中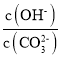 减小
减小
D.加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
【答案】C
【解析】
A.根据图象分析,溶液中δ(HCO3-)达到最大时溶液显碱性,碳酸氢根离子的水解程度大于电离出的,则溶液中c(H2CO3)>c(CO32-),A正确;
B.根据图象,当溶液中c(HCO3-)=c(CO32-)时溶液的pH为10.25,则溶液中c(H+)=10-10.25 mol/L,所以Ka2(H2CO3)= =c(H+)=10-10.25 mol/L,即Ka2(H2CO3)的数量级为10-11,B正确;
=c(H+)=10-10.25 mol/L,即Ka2(H2CO3)的数量级为10-11,B正确;
C.CO32-的一级水解平衡常数为Kh1=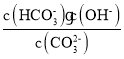 ,所以
,所以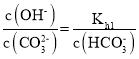 ,温度不变,Kh1不变,调节溶液的pH由8~10的过程中,c(HCO3-)减小,则
,温度不变,Kh1不变,调节溶液的pH由8~10的过程中,c(HCO3-)减小,则 增大,C错误;
增大,C错误;
D.加入NaOH使溶液pH=9时,HCO3-含量减小,CO32-含量增大,所以主要反应为HCO3-+OH-=CO32-+H2O,D正确;
故合理选项是C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
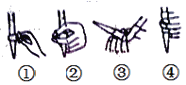
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。
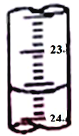
(4)根据下列数据:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 24.10 |
第二次 | 20.00 | 3.00 | 27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
【题目】下列选项中能发生化学反应,并且甲组为取代反应,乙组为加成反应的是
选项 | 甲 | 乙 |
A | 苯与溴水 | 乙烯与水制乙醇 |
B | 乙酸乙酯水解 | 苯与氢气 |
C | 乙醇的催化氧化 | 乙酸和乙醇的酯化反应 |
D | 乙烯与溴的四氯化碳溶液 | 甲烷与氯气 |
A.AB.BC.CD.D