题目内容
【题目】H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示:下列说法正确的是( )
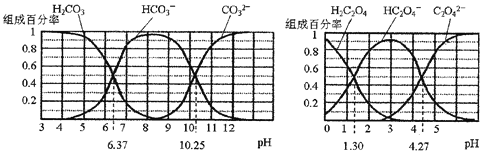
A.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应 HCO3-+H2O![]() H2CO3+OH-的平衡常数为
H2CO3+OH-的平衡常数为![]()
C.0.1 mol/L NaHC2O4溶液中c(C2O4-)+c(H2C2O4)=0.1 mol/L
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+ HC2O4-
【答案】D
【解析】
A. 在pH为6.37时,c(H2CO3)=c(HCO3-),pH为![]() 时,c(HCO3-)=c(CO32-),其它pH时离子浓度不符合等量关系,A错误;
时,c(HCO3-)=c(CO32-),其它pH时离子浓度不符合等量关系,A错误;
B. 反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为
H2CO3+OH-的平衡常数为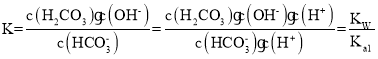 ,pH=6.37时,c(H2CO3)=c(HCO3-),Ka1=c(H+)=10-6.37,所以K=
,pH=6.37时,c(H2CO3)=c(HCO3-),Ka1=c(H+)=10-6.37,所以K=![]() =
=![]() =10-7.63,B错误;
=10-7.63,B错误;
C. 在0.1 mol/L NaHC2O4溶液中,存在的微粒有C2O42-、H2C2O4、HC2O4-,根据C元素守恒可得c(C2O42-)+c(H2C2O4)+c(HC2O4-)=0.1 mol/L,C错误;
D. 根据图象可知H2CO3的Ka1=10-6.37,H2C2O4的Ka1=10-1.3,可见草酸的酸性比碳酸强,往Na2CO3溶液中加入少量草酸溶液,能够生成碳酸氢根离子,发生反应:CO32-+H2C2O4=HCO3-+ HC2O4-,D正确;
故合理选项是D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目