题目内容
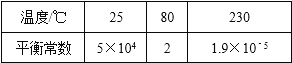
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
【答案】D
【解析】
A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度,平衡向吸热反应移动,故正反应为放热反应,故不选A;
B.25℃时反应Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为![]() =2×10-5,故不选B;
=2×10-5,故不选B;
C.80℃达到平衡时,测得n(CO)=0.3mol,c(CO)=![]() =1mol/L,故c[Ni(CO)4]=
=1mol/L,故c[Ni(CO)4]=![]() =
=![]() =2mol/L,故不选C;
=2mol/L,故不选C;
D.浓度商Qc=![]() ==8,大于80℃平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故选D;
==8,大于80℃平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故选D;
答案:D。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:
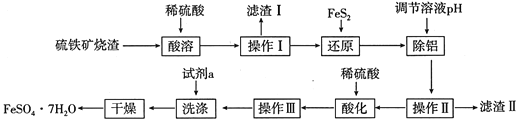
已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。