题目内容
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
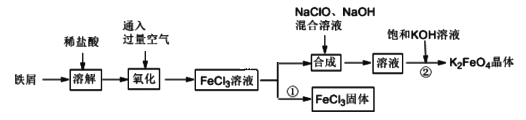
请回答下列问题:
(Ⅰ)(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为_______________________________。
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
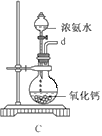
(4)过程①制取FeCl3固体的具体操作步骤是_______________________。若使6.5 mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH 小于_________{已知该实验条件下,Ksp[(Fe(OH)3]=6.5×10-36,Kw=1.0×10-13(水离子积)}
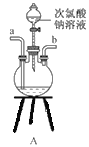
(Ⅱ)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
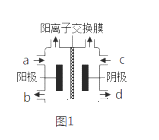
(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电解池总反应(化学方程式)__________________________________。
【答案】选用通入空气经济、而氯气有毒,污染环境 2Fe3++3ClO-+10OH-==2FeO42-+3C1-+5H2O c 需要在HC1气流中蒸发FeCl3溶液 1 d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑
2(CH3)4NOH+H2↑+Cl2↑
【解析】
(Ⅰ). (1)由于Fe2+具有较强的还原性,所以用空气氧化比用氯气氧化好,其优点是经济无污染;
(2)次氯酸根离子具有氧化性,能够把Fe3+在OH-环境下氧化为FeO42-,自身被还原为C1-,据以上分析写出离子方程式;
(3) KSCN 溶液、NaOH 溶液、苯酚溶液均能与铁离子反应,无法检验亚铁离子;溶液中存在氯离子,能够被酸性KMnO4褪色,无法检验亚铁离子;K3[Fe(CN)6]溶液与亚铁离子反应生成蓝色沉淀,可以检验;
(4)根据Ksp[(Fe(OH)3]计算出c(OH—),再根据Kw计算出c(H+),求出pH;
(Ⅱ)(1)以石墨为电极电解四甲基氯化铵制备四甲基氢氧化铵,电解过程中阴极得电子生成氢气、氢氧根离子,因此收集四甲基氢氧化铵的区域是阴极区;
(2)根据电解原理,电解过程中生成物为四甲基氢氧化铵、氢气和氯气。
(Ⅰ). (1)由于Fe2+具有较强的还原性,所以用空气氧化比用氯气氧化好,其优点是经济无污染;综上所述,本题答案是:选用通入空气经济,而氯气有毒、污染环境。
(2)次氯酸钠溶液、氢氧化钠溶液、氯化铁溶液混合反应生成高铁酸钠,离子方程式为2Fe3++3ClO-+10OH-==2FeO42-+3C1-+5H2O;综上所述,本题答案是:2Fe3++3ClO-+10OH-==2FeO42-+3C1-+5H2O。
(3) 该溶液中主要含有Fe3+,所以a、b、d都不能用;酸性KMnO4溶液也可用于检验溶液中是否含有Fe2+,但该溶液中含有Cl—,也能与KMnO4发生反应,使其褪色,无法检验亚铁离子,所以e不合理;K3[Fe(CN)6]溶液与亚铁离子反应生成蓝色沉淀,可以检验,可选用c;因此检验是否含有Fe2+,综上所述,本题答案是:c。
(4)已知c(Fe3+)=6.5 mol/L,Ksp[(Fe(OH)3]=6.5×10-36,所以c3(OH—)=![]() = 6.5×10-36/6.5=10-36, c(OH—)=1.0×10-12mol/L,Kw=1.0×10-13,所以溶液中的c(H+)=0.1 mol/L,pH=1,因此,为防止生成氢氧化铁沉淀,需控制溶液的pH小于1;综上所述,本题答案是:需要在HC1气流中蒸发FeCl3溶液;1。
= 6.5×10-36/6.5=10-36, c(OH—)=1.0×10-12mol/L,Kw=1.0×10-13,所以溶液中的c(H+)=0.1 mol/L,pH=1,因此,为防止生成氢氧化铁沉淀,需控制溶液的pH小于1;综上所述,本题答案是:需要在HC1气流中蒸发FeCl3溶液;1。
(Ⅱ)(1)以石墨为电极电解四甲基氯化铵制备四甲基氢氧化铵,需要氢氧根离子的参加,电解过程中阴极得电子生成氢气、氢氧根离子,因此收集四甲基氢氧化铵的区域是阴极区,即d口;综上所述,本题答案是:d。
(2)根据电解原理,电解过程中生成物为四甲基氢氧化铵,氢气和氯气,因此电解总反应为2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑;综上所述,本题答案是:2(CH3)4NCl+2H2O
2(CH3)4NOH+H2↑+Cl2↑;综上所述,本题答案是:2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。