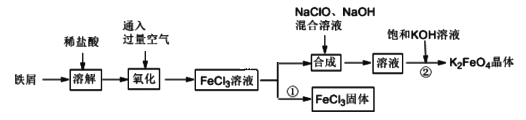
题目内容
【题目】短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________周期、_________族;G的元素符号是_________。
(2)B的原子结构示意图是_________;C与D组成的既含离子键又含共价键的化合物电子式是_________。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:

X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________,Y溶液与过量W反应的离子方程式是___________________________________。
【答案】二 第ⅥA Cl 
![]() 2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ClO- + 2I- +2H+ = Cl- + I2 + 2H2O HNO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ClO- + 2I- +2H+ = Cl- + I2 + 2H2O HNO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
根据题目信息科推出:A的原子半径最小(稀有气体元素除外),A是H;C的最外层电子数是次外层的3倍,C是O;B与C相邻,B是N;E是地壳中含量最多的金属元素,E是Al;C、D的最外层电子数之和与G的最外层电子数相等,D是Na;G是Cl。
(1)C是O,在元素周期表中的位置是第二周期,第ⅥA族;G的元素符号是Cl;故答案为:二;第ⅥA;Cl;
(2)B是N,原子结构示意图是 ;C与D组成的既含离子键又含共价键的化合物是Na2O2,电子式是:
;C与D组成的既含离子键又含共价键的化合物是Na2O2,电子式是:![]() ;故答案为:
;故答案为: ;
;![]() ;
;
(3)铝与氢氧化钠溶液反应的化学方程式为:2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑;由上述六种元素中的三种组成的盐是NaClO,将它滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,说明有碘单质生成,离子方程式是ClO- + 2I- +2H+ = Cl- + I2 + 2H2O;故答案为:2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑;ClO- + 2I- +2H+ = Cl- + I2 + 2H2O;
(4)A、B、C、E分别是H、N、O、Al,Z是一种强酸,则Z是HNO3;由于X、Y、Z、W中均由三种元素组成,X是Al(OH)3,Y是Al(NO3)3、Z是HNO3、W是NH3·H2O, Y溶液与过量W反应的离子方程式是: Al3++3NH3·H2O=Al(OH)3↓+3NH4+;故答案为:HNO3; Al3++3NH3·H2O=Al(OH)3↓+3NH4+。

【题目】(1)现有A、B、X、Y、Z五种短周期元素,原子序数依次增大。它们的性质或原子结构如下表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含量最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素 |
Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
①X元素在元素周期表中的位置是______________;
②Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为___________________________________________________;
③化合物甲由A和B两种元素组成且质量比为3:14,甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示
X | ||
Y | ||
Z |
①X元素单质的化学式是_________,若X核内中子数与质子数相等,则X单质的摩尔质量为________;
②Y单质的电子式是_________;Z与钙形成的化合物的电子式是__________。
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)