题目内容
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
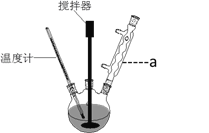
(1)仪器a的名称:__________;装置C中三颈瓶置于冰水浴中的目的是_____________。
(2)装置B吸收的气体是__________,装置D的作用是___________________________。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为________________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③________________________________________________________。(补充完整)
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+![]() Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为____________。
Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为____________。
【答案】分液漏斗防止Cl2与KOH反应生成KClO3HCl吸收Cl2,防止污染空气3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O将滤液置于冰水浴中,向滤液中加入饱和KOH溶液90%
【解析】
根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收,(1)根据装置图可知仪器名称;Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,据此判断冰水浴的原因;(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收;(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,据此书写该反应的离子方程式;(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,据此答题;(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,利用(NH4)2Fe(SO4)2的物质的量可计算得高铁酸钾的质量,进而确定K2FeO4样品的纯度。
(1)根据装置图可知仪器a的名称是分液漏斗,Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000 mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×![]() ×
×![]() =0.198g,所以K2FeO4样品的纯度为
=0.198g,所以K2FeO4样品的纯度为![]() ×100%=90.0%。
×100%=90.0%。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________、____________。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________。
(2)F在元素周期表中的位置为___________________________________。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______。
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________、___________________(至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)。
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |