��Ŀ����
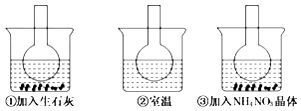
����Ŀ��I.����Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ء� ��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز���������

�Իش��������⣺
(1)ȼ�ϵ�ص��ŵ���________���������Һ�е�OH-����______��(�����������)��
(2)д������ȼ�ϵ�ع���ʱ������Ӧʽ��_______________________��
(3)������ȼ�ϵ�ظĽ�Ϊֱ���Լ��������Ϊԭ�Ͻ��й���ʱ��������ӦʽΪ___________��
(4)���ø�װ�ÿ��Դ��������������NH3 β��,�ܷ�ӦΪ��6NO2 +8NH3=7N2+12H2O��������ӦʽΪ__________��
II.��пƬ����Ƭ����ϡ���������ԭ��أ����õ�������缫��������Ϊ80 g������һ��ʱ���ȡ��пƬ����Ƭϴ���������أ�������Ϊ41g���Լ��㣺
��1���������������(��״��)Ϊ________________��
��2��ͨ�����ߵĵ�����Ϊ__________����NA��ʾ����
���𰸡� ���������ʸߣ���ɫ����Ⱦ �� 2H2O��O2��4e��===4OH�� CH4��10OH����8e��===CO![]() ��7H2O 2NH3 -6e- +6OH-=N2+6H2O 13.44 L 1.2NA
��7H2O 2NH3 -6e- +6OH-=N2+6H2O 13.44 L 1.2NA
����������1����Ϊ��������������ȼ�ϵ�أ�����Ϊˮ������������������ȼ�շų��������ߣ�����(1)ȼ�ϵ�ص��ŵ������������ʸߣ���ɫ����Ⱦ������ԭ��ع���ԭ�����ڵ������Һ�У����������ƶ����������������ƶ������Դ�Ϊ�����������ʸߣ���ɫ����Ⱦ ����
(2) �������������õ��Ӻ�ˮ�������������ӣ�������ԭ��Ӧ�����Ե缫��ӦʽΪ2H2O+O2+4e-=4OH-������ȼ�ϵ��������Ӧʽ��2H2O+O2+4e-=4OH-��
��3����Ϊ���ڼ�����Һ�У���������Ȼ�������õ��Ӻ�ˮ�������������ӣ�������ԭ��Ӧ�����Ե缫��ӦʽΪ2O2+4H2O+8e-=8OH-���������Ǽ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ�����Ե缫��ӦʽΪCH4��10OH����8e��=CO![]() ��7H2O���𰸣�CH4��10OH����8e��=CO32-��7H2O
��7H2O���𰸣�CH4��10OH����8e��=CO32-��7H2O
(4)����ԭ��ع���ԭ��������������������ԭ������������6NO2 +8NH3=7N2+12H2O�ж�NO2Ϊ��������NH3Ϊ��ԭ�������Ը�����ӦʽΪ2NH3 -6e- +6OH-=N2+6H2O��
II. ��1����пƬ����Ƭ����ϡ���������ԭ��أ�п������ʧ���ӷ���������Ӧ�������е����������������õ��ӷ�����ԭ��Ӧ�����õ�������缫��������Ϊ80g������һ��ʱ���ȡ��пƬ����Ƭϴ���������أ�������Ϊ41g������������39g������ԭ��ع���ԭ��֪�����ٵ�������пʧ���ӣ����п���ӡ����ݵ����غ�Fe![]() H2������״�������������Ϊ39g/65g.mol-1
H2������״�������������Ϊ39g/65g.mol-1![]() 22.4l.mol-1= 13.44 L��
22.4l.mol-1= 13.44 L��
��2��ͨ�����ߵĵ�����Ϊ39g/65g.mol-1![]() 2NA=1.2NA
2NA=1.2NA

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm����
Ԫ�ش��� | A | B | C | D | E | F | G |
ԭ�Ӱ뾶/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
��Ҫ���ϼ� | +1 | +2 | +3 | +6��-2 | -1 | -2 | +5��-3 |
(1)CԪ����Ԫ�����ڱ��е�λ���� ______ ��
(2)B��ԭ�ӽṹʾ��ͼΪ ______ ��
(3)D��E��̬�⻯����ȶ���ǿ��˳��Ϊ ______ ���ѧʽ����
(4)��������Ԫ�ص�����������Ӧˮ������������ǿ���� ______ ���ѧʽ����
(5)��CΪ�����Ƴɵ�������������ǿ����Һ�������ӷ���ʽ��ʾ��ԭ��Ϊ�� ______ ��
(6)�ڣ�52Te����ij�������dz��õ�VCR���̼�¼����֮һ�����ڼ��������·�����ѧ�����������ܸı����¼�������źţ��Ʋ���Ԫ�������ڱ��е�λ�ã�����Ԫ�ؼ��仯������ܾ��е�����Ϊ��______ ��
A���������ڳ������ǹ���B��Cl2ͨ��H2Te��Һ�в�������Ӧ
C��H2Te����HI�ȶ� D��H2TeO4�����Ա�H2SO4����
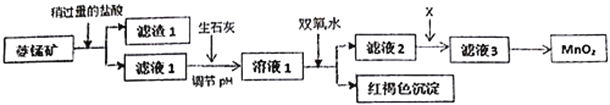
����Ŀ����ҵ�������̿�MnCO3���ۺ�FeCO3��SiO2��Cu2(OH)2CO3�����ʣ�Ϊԭ����ȡ�������̣�������ʾ��ͼ���£�
��֪�������������������pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3��10-16 Ksp(MnS)= 3��10-14
ע���������ӵ���ʼŨ��Ϊ0.1 mol/L
�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ����_________________________������1�ijɷ���_________�������ܽ�MnCO3�����ӷ���ʽ��_________________________________��
��2������ʯ�Ҷ�����NaOH����pH��ԭ����_______________________________��
��3����Һ2�м���ij������X���Գ�ȥCu2+�����ʺϵ���_______________��
A.MnO2 B.NaOH C.MnS
�÷�Ӧ�����ӷ���ʽ��____________________________��
��4����MnCl2ת��ΪMnO2��һ�ַ����ǽ��ữ��NaClO3��Һ����Mn2+���벹�䲢��ƽ���з��̣�____Mn2++_____ClO3-+______��____Cl2��+____MnO2+_________��_________________
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ�����������������������������������
�� MnO2�ڵ��ص�__________________������������������������������������ɣ�
�� ��ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ�����_______________��
����Ŀ����ҵ�����е�NO2��CO2�Ի������м���Ӱ�죬���û�ѧ��Ӧԭ�����䴦�����Թ�������ˮ��ɽ����̬��������Ҫ���塣��ش���������:
(1)����˵����ȷ����_________
A.CO2��NO2��ˮ��Ӧ������Һ��Ϊ����
B.NO2��һ������������NH3��Ӧ���ɻ����Ѻõ�����
C.ͨ���ⶨ��Һ��pH��һ�����ж�H2CO3��HNO2������ǿ��
D.Na2CO3��Һ�м������������CO2
(2)H2�ڴ�������������NO2��Ӧ����ˮ�����͵�������ȥ��ҵβ����NO2����Ⱦ��
��֪:��N(g)+2O2(g)=2NO2(g)��H=+133kJ/mol����H2O(g)=H2O(1)��H=-44kJ/mol;��H2��ȼ����Ϊ285.8kJ/mol,�÷�Ӧ���Ȼ�ѧ����ʽΪ___________.
(3)CO2����һ��������ת��ΪCH3OH����֪��2L�ܱ������м���2molCO2��6molH2,���ʵ��Ĵ�����T1�¶���,������Ӧ:CO2(g)+3H2(g) ![]() CH3OH(1)+H2O(1)��H<O,10minʱ�ﵽƽ��״̬��10min��ı��¶�ΪT2,������ȫ��Ϊ���壬20minʱ�ﵽƽ��״̬����Ӧ�����в������ݼ���:
CH3OH(1)+H2O(1)��H<O,10minʱ�ﵽƽ��״̬��10min��ı��¶�ΪT2,������ȫ��Ϊ���壬20minʱ�ﵽƽ��״̬����Ӧ�����в������ݼ���:
��Ӧʱ�� | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
0min | 2 | 6 | 0 | 0 |
10min | 4.5 | |||
20min | 1 |
��ǰ10min�ڵ�ƽ����Ӧ����v(CO2)=_______��20minʱH2��ת����Ϊ_______��
���������������������£���30minʱֻ�ı��¶�ΪT3,��ƽ��ʱH2�����ʵ���Ϊ3.2mol,��T2______T3(�>����<����=��)�����¶�T2ʱ����Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______��
����T1�¶���,�������ݻ���Сһ������Ӧ��ƽ��ʱCH3OH���ʵ���Ϊ____mol.�ı�������������ʹH2�ķ�Ӧ���ʺ�ת���ʶ�һ���������____(����)��
A.���ݻ������������¶�
B.���������²��䣬����ѹǿ
C.���ݻ����¶Ȳ����³���N2
D.���ݻ����¶Ȳ����¼�ʱ�����CH3OH