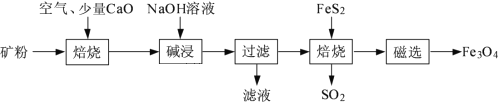
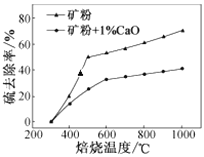
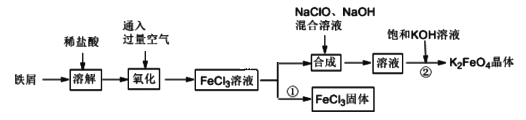
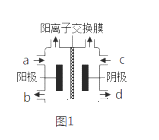
题目内容
【题目】碘化钠在医药上用作祛痰剂和利尿剂,也用于治疗甲状腺肿病,生活中用作照相胶片感光剂,碘的助溶剂,也用于配制碘乳剂。某实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
回答下列问题:
(1)水合肼的制备原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置组装制备水合肼,连接顺序为_____→ → → → → (用字母表示).
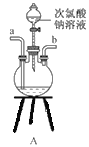
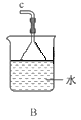
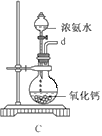
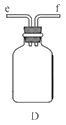
②装置C中发生反应的化学方程式为________________,装置D的作用是_______________。
(2)碘化钠的制备步骤
向三颈烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60-70℃至反应充分;继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;将分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①反应温度不宜超过70℃的原因是___________________ ,该步骤反应完全的现象是______________。
②IO-被还原的离子方程式为_______________________________。
③“将溶液与活性炭分离”的方法是____________。
④该实验小组产率为________________。
【答案】defabc(ef的顺序能互换) CaO+NH3·H2O=NH3↑+Ca(OH)2 防止倒吸或作安全瓶 防止碘升华 无固体残留且溶液呈无色 2IO-+N2H4=N2↑+2I-+2H2O 趁热过滤 81.0%
【解析】
本题为实验题,要结合实验目的和实验步骤进行分析,并利用得失电子守恒配平相应的氧化还原反应方程式,利用方程式进行计算;
(1)①装置A制备水合肼,装置B防倒吸,装置C提供氨气,装置D防止倒吸或作安全瓶,故连接顺序为defabc ②装置C提供氨气,反应物为浓氨水和氧化钙,故反应方程式为CaO+NH3·H2O=NH3↑+Ca(OH)2;装置D的作用为:防止倒吸或作安全瓶;
(2)①由于在加热条件下碘易升华,所以反应装置温度不宜过高,防止碘升华;反应完全时,碘单质全部转化为NaIO和NaIO3,故现象为无固体残留且溶液呈无色;②由题意可知水合肼还原NaIO,IO-被还原为I-,水合肼中N元素升价,得到N2,利用得失电子守恒,将反应方程式配平,得到2IO-+N2H4=N2↑+2I-+2H2O;③活性炭难溶于水,为了防止NaI由于温度降低结晶析出,故将溶液与活性炭分离的方法是趁热过滤;④反应前加入25.4g单质碘,即0.1mol单质碘,由原子守恒可知,应得到0.2mol NaI,即30g NaI。实验过程中得产品24.3g,故产率=24.3g/30g×100%=81%;

【题目】(1)现有A、B、X、Y、Z五种短周期元素,原子序数依次增大。它们的性质或原子结构如下表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含量最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素 |
Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
①X元素在元素周期表中的位置是______________;
②Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为___________________________________________________;
③化合物甲由A和B两种元素组成且质量比为3:14,甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示
X | ||
Y | ||
Z |
①X元素单质的化学式是_________,若X核内中子数与质子数相等,则X单质的摩尔质量为________;
②Y单质的电子式是_________;Z与钙形成的化合物的电子式是__________。
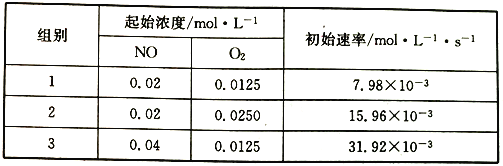
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
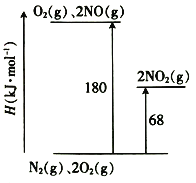
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)