题目内容
【题目】为了使AlCl3溶液中的Al3+离子尽可能全部转化为Al(OH)3沉淀,最合适的试剂是( )
A.NaOH溶液
B.KOH溶液
C.盐酸
D.氨水
【答案】D
【解析】解:由于氢氧化钠溶液和氢氧化钾都是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,故氯化铝中的铝离子难以完全反应,故A、B不是最好的试剂; C.稀硫酸不与氯化铝反应,故C不能制得氢氧化铝;
D.氨水是弱碱溶液,可以全部沉淀Al3+ , 且Al(OH)3不溶于弱碱氨水溶液,故D正确.
故选D.

练习册系列答案
相关题目
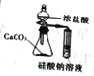
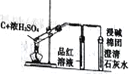
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D