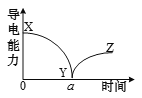
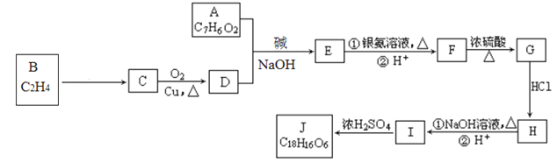
题目内容
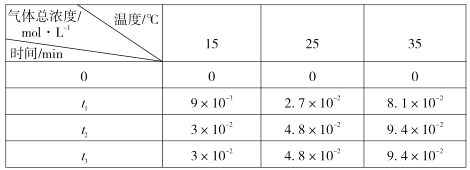
【题目】如图为室温下某二元酸H2M溶液中H2M、HM-、M2-的浓度对数lgc随pH的变化图象。下列分析错误的是

A.该二元酸溶液浓度为0.010 mol/L
B.pH=1.89时,c(H2M)=c(HM-)>c(M2-)
C.pH=7.0时,lgc(M2-)-lgc(HM-)=0.77
D.在NaHM溶液中,水的电离受到抑制
【答案】A
【解析】
据图可知溶液中H2M、HM-、M2-三种微粒可以同时存在,所以H2M应为二元弱酸, pH增大的过程中发生反应:H2M+OH-=HM-+H2O、HM-+OH-=M2-+H2O;
A.起点处,溶液中主要存在H2M![]() HM-+H+,据图可知c(H2M)=0.1mol/L,c(HM-)=0.001mol/L,根据物料守恒,二元酸的浓度应为0.1mol/L+0.001mol/L=0.101mol/L,故A错误;
HM-+H+,据图可知c(H2M)=0.1mol/L,c(HM-)=0.001mol/L,根据物料守恒,二元酸的浓度应为0.1mol/L+0.001mol/L=0.101mol/L,故A错误;
B.据图可知pH=1.89时c(H2M)=c(HM-)>c(M2-),故B正确;
C.lgc(M2-)-lgc(HM-)=lg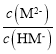 ,Ka2=
,Ka2=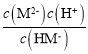 ,据图可知pH=6.23时,
,据图可知pH=6.23时,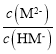 =1,所以Ka2=10-6.23,温度不变平衡常数不变,所以pH=7.0时
=1,所以Ka2=10-6.23,温度不变平衡常数不变,所以pH=7.0时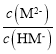 =
=![]() ,所以lg
,所以lg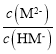 =0.77,故C正确;
=0.77,故C正确;
D.在NaHM溶液中含M元素主要以HM-的形式存在,据图可知当溶液中c(HM-)最大时,溶液呈酸性,说明HM-的电离程度大于水解程度,而电离抑制水的电离,水解促进水的电离,所以水的电离受到的抑制作用更大,故D正确;
故答案为A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3![]() TiCl4↑+TiCl2回答下列问题。
TiCl4↑+TiCl2回答下列问题。
(1)某同学所画基态 Cl-的外围电子排布图为![]() ,这违反了____________
,这违反了____________
(2)从结构角度解释 TiCl3中Ti(III)还原性较强的原因____________。
(3)钛的氯化物的部分物理性质如下表:
氯化物 | 熔点/℃ | 沸点/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非极性的甲苯和氯代烃 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是____________。
②TiCl4与SO42-互为等电子体,因为它们____________相同;SO42-中心原子以3s轨道和3p轨道杂化。
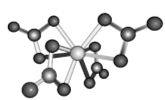
(4)Ti的配合物有多种。Ti(CO)6、Ti(H2O)63+、TiF62-的配体所含原子中电负性最小的是__________;Ti(NO3)4的球棍结构如图,Ti的配位数是_____________
(5)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图:
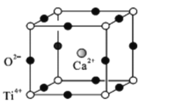
①设N为阿伏加德罗常数的值,计算一个晶胞的质量为______________g.
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则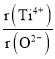 =_________。
=_________。
【题目】下列离子组加入相应试剂后,发生反应的离子方程式正确的是( )
离子组 | 加入试剂 | 离子方程式 | |
A | Na+、 | Ba(OH)2溶液 | 2Na++ |
B | H+、Cl- | 足量石灰乳 | 2H++2OH-=2H2O |
C | K+、 | NaHSO4溶液 |
|
D | Ag+、 | 少量盐酸 | Ag++ |
A.AB.BC.CD.D