题目内容
【题目】(1)欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3的物质的量为____mol(已知:KClO3被还原成KCl)。
(2)向200mL0.1mo/L 的Fe(NO3)2溶液中加入适量的NaOH 溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧后得到固体的质量为___g。
(3)将0.51g的Mg、Al混合物溶于500mL,4mol/L HCl,加入2mol/L NaOH,要使沉淀的量达到最大值,则加入NaOH的量最少为___mL。
(4)200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增大了7.2g,则原混合气体的物质的量为____mol。
【答案】0.5 1.6 1000 1.0
【解析】
(1)根据氧化还原反应化合价变化确定得失电子数,进而确定氧化剂的含量;
(2)根据Fe2+的不稳定性,加碱后加热蒸干会被氧化,灼烧生成Fe2O3,进而计算;
(3)根据Mg、Al与HCl反应后再和 NaOH反应的现象不同进行判断;
(4)根据气体质量变化,确定生成氧气的量,再根据关系式计算原混合气体的物质的量。
(1)根据得失电子守恒:由VO2+![]() VO2+
VO2+![]() e-,欲使3mol的VO2+变为VO2+需失去3mol e-,则需要氧化剂KClO3
e-,欲使3mol的VO2+变为VO2+需失去3mol e-,则需要氧化剂KClO3![]() KCl
KCl![]() 6e-,根据得失电子守恒:6e-
6e-,根据得失电子守恒:6e-![]() x=3mol e-,解得x=0.5mol,所以需要氧化剂KClO3的物质的量为0.5mol ;答案:0.5。
x=3mol e-,解得x=0.5mol,所以需要氧化剂KClO3的物质的量为0.5mol ;答案:0.5。
(2)Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+完全沉淀,得到硝酸钠与氢氧化亚铁,过滤,小心加热沉淀,再灼烧至质量不再变化,由于氢氧化亚铁易被氧化,最终所得固体为Fe2O3 ,200mL0.1mol. L-1的Fe( NO3 )2溶液中n[ Fe( NO3 )2 ]=0.2L ![]() 0.1mol/ L=0.02mol,由Fe原子守恒可知:n[ Fe( NO3)2]=2n(Fe2O3),所以 n(Fe2O3)=
0.1mol/ L=0.02mol,由Fe原子守恒可知:n[ Fe( NO3)2]=2n(Fe2O3),所以 n(Fe2O3)=![]() =0.01mol,其质量为0.01mol
=0.01mol,其质量为0.01mol ![]() 160g/mol= 1.6g答案: 1.6 ;
160g/mol= 1.6g答案: 1.6 ;
(3)根据题意知,反应过程中镁铝的转化过程分别为: Mg→MgCl2→Mg(OH)2;Al→AlCl3→Al(OH)3, Mg、Al、Mg(OH)2、Al(OH)3 都不溶于水,所以沉淀质量达到最大值时溶液中的溶质是氯化钠, 根据元素守恒:n(NaOH)= n(HCl)计算,设加入2mol/L的氢氧化钠溶液的体积为 xL,2mol/L![]() xL= 0.5L
xL= 0.5L![]() 4mol/L ,x= 1,所以需加入2mol/L的氢氧化钠溶液的体积为1L即1000mL;答案:1000;
4mol/L ,x= 1,所以需加入2mol/L的氢氧化钠溶液的体积为1L即1000mL;答案:1000;
(4)200°C时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应,发生反应:2 Na2O2+ 2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑ 固体只增加了7.2g,是因为生成O2,根据质量守恒定律可知m(O2)=23.2g-7.2g=16g,所以n(O2)= ![]() =0.5mol;根据方程式可知:n(混合气体)=2n(O2)=2
=0.5mol;根据方程式可知:n(混合气体)=2n(O2)=2![]() 0.5mol=1.0mol。答案:1.0mol。
0.5mol=1.0mol。答案:1.0mol。

【题目】金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键。
步骤:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJmol-1,ΔS=+61JK-1mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)![]() TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)![]() TiCl4(g)+2CO(g) ΔH2,△S2
TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJmol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJmol-1
请回答:
(1)反应Ⅰ的ΔH1=__kJmol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=__(用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJmol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见表:
实验组别 | 1 | 2 | 3 | 4 |
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
反应时间/h | 3 | 3 | 3 | 3 |
容器体积/L | 2 | 2 | 2 | 2 |
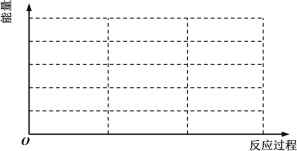
①请在如图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。___
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为___molL-1h-1。判断组别4中反应是否达到平衡状态___(填“是”或“否”),并说明理由___。