题目内容
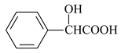
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
【答案】水浴 因为NaI固体溶于水产生I-(aq)与I2(S)反应形成I3-(aq),使固体I2溶解性增加,导致浓度增加,使与NaHCO3溶液反应的反应速率加快 N2H4·H2O+2IO-=N2↑+2I-+3H2O ABA AD 减压环境与外界空气隔绝,避免I-被氧化;降低压强,沸点降低,利于水的蒸发 ③→②→④→⑤
【解析】
本实验目的是将碘单质转化为碘化钠并纯化得到NaI·2H2O,根据题目所给流程,将I2与碳酸氢根反应得到碘的各种酸根,此步骤目的是使碘单质尽可能大的转移到溶液;随后向溶液中加入水合肼,水合肼的加入可以使溶液中碘的各种酸根和未反应的碘单质全部还原为I-,此时溶液中主要成分为NaI,经步骤Ⅲ的多步操作除去溶液中其他可溶性大量杂质得到粗NaI溶液,将溶液经过蒸发、抽滤得到NaI·2H2O粗晶体,粗晶体经过重结晶制得高纯NaI·2H2O晶体,据此分析。
(1)①反应温度为40-70℃可利用水浴的方式进行反应,水浴加热可以较为精准的控制温度;
②反应过程中加入少量的NaI,碘化钠电离出的I-可以结合I2生成![]() ,使固体I2溶解性增加,导致浓度增加,使与NaHCO3溶液反应的反应速率加快;
,使固体I2溶解性增加,导致浓度增加,使与NaHCO3溶液反应的反应速率加快;
(2)根据已知条件,水合肼可以和IO-发生反应生成I-和无毒的物质N2,反应的离子方程式为N2H4·H2O+2IO-=N2↑+2I-+3H2O;
(3)步骤①是将酸性溶液调整为碱性溶液并在100℃下保持8h,需要选择碱性溶液调整pH,一水合氨虽然为碱性,电离出的OH-可以调整酸碱性,但是在高温条件下溶液中的铵根离子易发生水解,未反应的一水合氨受热分解,使溶液变回酸性,不能保持溶液pH的恒定,故选择NaOH溶液;步骤②是将碱性溶液调整为酸性溶液,需要向溶液中加入酸,故选择HF;步骤③需要将酸性溶液调整为碱性溶液,同时需要将溶液煮沸,若加入一水合氨,一水合氨在高温条件下易分解,使溶液变回酸性故选择NaOH,故步骤①和③选择NaOH作为pH调整试剂,步骤②选择HI作为pH调整试剂,选择ABA;
(4)①在冷凝管的选择上,直形冷凝管一般用于蒸馏装置,用于物质的分离,而球形冷凝管一般用于反应装置,用于回流,故选择直形冷凝管;因为减压蒸馏,需要降低装置内的压强,故需要抽气泵减小装置内部压强,选择AD;
②减压蒸发可以将物质与外界空气隔绝,避免I-被氧化,同时降低装置内压强,使水的沸点降低,利于水的蒸发;
(5)根据已知条件,NaI易溶于水,也易溶于酒精可利用加入乙醇的方法重结晶,先将乙醇加热,再将碘化钠粗品溶解在热的乙醇溶液中,因碘化钠在乙醇中的溶解度随温度的升高变化不大这一特性,经碘化钠的醇溶液减压蒸发至有大量固体出现时,趁热过滤,这样粗品中的杂质就就在乙醇中,而较高纯度的碘化钠就留在滤纸上,然后为防止I-被氧化,需要通过真空干燥的方式制得纯净晶体,故顺序为③→②→④→⑤。

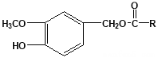
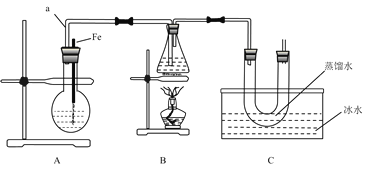
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1) B中发生反应生成目标产物的化学方程式为_________。
(2)根据实验目的,选择下列合适的实验步骤:①→___________(选填②③④等)。
①组装好装置,___________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_____。
(4)冰水的作用是_______。
(5)反应完毕后,U形管内的现象是______________;分离溴乙烷时所需的玻璃仪器有_____。