题目内容
【题目】(1)25 ℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=____________。
②为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg![]() 。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合H+能力最强的是____。
②根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:_______;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__mol/L。
【答案】1∶ 9 0 -2pH+14 CO32- C Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ 4.0×10-8
【解析】
(1)①酸碱中和反应后溶液显碱性时,利用c(OH-)=[n(OH-)-n(H+)]/(Va+Vb)计算;
②利用Kw=c(H+)×c(OH-)进行计算;
(2)①利用盐的水解规律,越弱越水解解释;
②酸性越强,电离出的氢离子浓度越大,加水稀释相同倍数时,pH变化越大;
(3)利用Ksp计算。
(1)①25 ℃时,Kw=10-14,pH=a的某一元强碱,a=13,浓度为0.1mol/L,pH=b的某二元强酸,b=2,浓度为0.01mol/L,所得溶液的pH=11,c(OH-)=0.001mol/L,则0.1mol/L×Va-0.01mol/L×Vb=0.001mol/L×(Va+Vb),化简求解Va∶Vb=1∶9;
②25 ℃时,若溶液呈中性,c(H+)=c(OH-),AG=lg1=0;AG=lg![]() =lgc(H+)-lgc(OH-)=2lgc(H+)-lgKw=-2pH+14;
=lgc(H+)-lgc(OH-)=2lgc(H+)-lgKw=-2pH+14;
(2)①上述5种盐均为强碱弱酸盐,溶液显碱性,弱酸根离子越弱,结合氢离子能力越强,碱性越强,根据表中数据,CO32-结合H+能力最强;
②酸性越强,电离出的氢离子浓度越大,加水稀释相同倍数时,pH变化越大,根据表中数据,CH3COOH酸性最强,答案为C;
(3)FeCl3溶液与NaHCO3溶液混合生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;若将所得悬浊液的pH调整为4,溶液中c(H+)=10-4mol/L,则c(OH-)=Kw/c(H+)=10-10mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,则c(Fe3+)=4.0×10-38/10-30=4.0×10-8mol/L。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
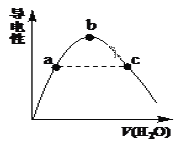
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。