题目内容
15.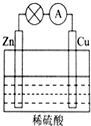 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.(2)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是Pb.工作时,电解质溶液的酸性减小(填“增大”、“减小”或“不变”).工作时,电解质溶液中阴离子移向负极(填“正”或“负”).电子流动方向为从负极流向正极(填“正”或“负”).
分析 (1)根据锌比铜活泼,所以锌作负极,氢离子在正极Cu上得电子生成氢气,根据消耗的金属的量计算生成气体的量;
(2)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极、失电子化合价升高的金属为负极;
放电时,H2SO4参加反应导致溶液中c( H+)降低;放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;电流从正极沿导线流向负极.
解答 解:(1)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
$\frac{65}{6.5}$=$\frac{2}{X}$
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2;
(2)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,失电子化合价升高的金属为负极,则Pb为负极,放电时,H2SO4参加反应导致溶液中c( H+)降低,则溶液pH增大、酸性减小,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,电流从正极PbO2沿导线流向负极Pb,故答案为:Pb;减小;负;负;正.
点评 本题考查了原电池原理,明确正负极上发生反应及元素化合价变化即可解答,知道电流方向、电解质溶液中阴阳离子移动方向等知识点,题目难度不大.

练习册系列答案
相关题目
5.某铁矿石样品的主要成分为铁的氧化物,还含有少量SiO2.某化学兴趣小组对该铁矿石中铁元素的价态及含量进行如下探究:
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
③问题讨论:
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
3.25℃时,将amol.L-1、pH=m的一元酸HX溶液与bamol.L-1、pH=n的一元碱YOH溶液等体积混合,下列说法正确的是( )
| A. | 若a=b,则混合后溶液中一定有:c(X-)=c(Y+)>c(H+)=c(OH-) | |
| B. | 若m+n=14,则混合后溶液一定显中性 | |
| C. | 若混合后溶液中c(X-)<c(Y+),则该混合溶液一定显碱性 | |
| D. | 若a=b,混合后溶液pH<7,则混合溶液中一定存在:c(Y-)=c(X-)+c(HX) |
10.下列叙述正确的是( )
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
20.下列叙述正确的是( )
| A. | 相同浓度的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,铵根浓度大小关系为(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl | |
| B. | 向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 | |
| C. | 0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 | |
| D. | 0.2 mol/L的NaHCO3溶液中c(H+)+c(Na+)═c(CO32-)+c(OH-)+c(HCO3-) |
7.生活中处处存在化学,下列说法不正确的是( )
| A. | 热水瓶胆中的水垢可以用食醋除去 | |
| B. | 福尔马林用于标本的制作是利用了使蛋白质变性的性质 | |
| C. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| D. | 在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
5.四氯苯的同分异构体数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |