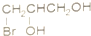
题目内容
1.下列离子方程式正确的是( )| A. | 铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸钙和稀硝酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 稀硫酸和Ba(OH)2溶液反应:Ba2++H++SO42-+OH-═BaSO4↓+H2O | |
| D. | Cl2和FeCl2溶液反应:Cl2+Fe2+═Fe3++2Cl- |
分析 A.发生氧化还原反应生成NO;
B.反应生成硝酸钙、水、二氧化碳;
C.不符合离子的配比;
D.反应生成氯化铁,电子、电荷不守恒.
解答 解:A.铁和足量稀硝酸反应的离子反应为Fe+NO3-+4H+═Fe3++NO↑+2H2O,故A错误;
B.碳酸钙和稀硝酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故B正确;
C.稀硫酸和Ba(OH)2溶液反应的离子反应为Ba2++2H++SO42-+2OH-═BaSO4↓+2H2O,故C错误;
D.Cl2和FeCl2溶液反应的离子反应为Cl2+2Fe2+═2Fe3++2Cl-,故D错误;
故选B.
点评 本题考查离子反方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
11.下列各组粒子中,所含化学键类型有差异的是( )
| A. | CCl4 和CH2Cl2 | B. | H3O+ 和NH4+ | C. | CaO2 和 CaF2 | D. | Ba(0H)2 和NaOH |
12.设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |
9.向一定浓度的下列物质的澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是( )
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
| A. | ①③④ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
16.反应3Fe(s)+4H2O(g)$\stackrel{高温}{?}$Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变会使化学反应速率加快的是( )
| A. | 增加Fe的量 | |
| B. | 将容器的容积缩小一半 | |
| C. | 保持容积不变,充入N2使体系压强增大 | |
| D. | 压强不变,充入N2使容器容积增大 |
10.下列叙述正确的是( )
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |

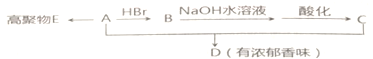
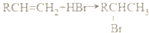
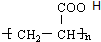 .
.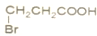 B、
B、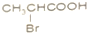 C、
C、 D、
D、