题目内容
17.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 1mol Fe与足量的盐酸反应,转移3nA个电子 | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1nA个NO3- | |
| C. | 常温下,34gNH3含有2nA个NH3分子 | |
| D. | 常温常压下,22.4LNO2含有2nA个氧原子 |
分析 A、1mol铁与盐酸反应生成的是亚铁离子失去2mol电子;
B、溶液体积不明确;
C、求出氨气的物质的量,然后根据分子个数N=nNA来计算;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、1mol铁与盐酸反应生成的是亚铁离子失去2mol电子,故转移2mol电子,即2nA个,故A错误;
B、溶液体积不明确,故溶液中NO3-的个数无法计算,故B错误;
C、34g氨气的物质的量n=$\frac{34g}{17g/mol}$=2mol,而分子个数N=n•nA=2nA,故C正确;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化氮的物质的量小于1mol,则含有的氧原子的个数小于2nA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列说法中,正确的是( )
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
8.下列粒子半径比较中,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
5.有机物的命名是有规则的,下列有机物用系统命名法命名正确的是( )
| A. | 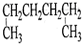 1,4-二甲基丁烷 | B. | 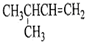 3-甲基丁烯 | C. | 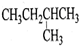 2-甲基丁烷 | D. | 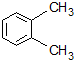 邻二甲苯 |
12. 溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
(1)仪器乙的名称为:球型冷凝管;
(2)用如图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应.反应中铁屑的作用是:催化剂;
写出制备溴苯的化学反应方程式是:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)丁装置烧杯中倒置的漏斗的目的是:防倒吸;
写出丁中发生的主要化学反应的方程式为:NaOH+HBr=NaBr+H2O;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂A除去,
A 氢氧化钠溶液 B稀盐酸溶液 C氯化钠溶液 D水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作G除去.
E 重结晶 F 过滤 G 蒸馏 H 萃取.
 溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)用如图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应.反应中铁屑的作用是:催化剂;
写出制备溴苯的化学反应方程式是:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)丁装置烧杯中倒置的漏斗的目的是:防倒吸;
写出丁中发生的主要化学反应的方程式为:NaOH+HBr=NaBr+H2O;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂A除去,
A 氢氧化钠溶液 B稀盐酸溶液 C氯化钠溶液 D水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作G除去.
E 重结晶 F 过滤 G 蒸馏 H 萃取.
9.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
6.以下事实,表明硝酸具有强氧化性的是( )
| A. | 硝酸可以和大理石反应 | |
| B. | 氢氧化铁沉淀可溶于硝酸 | |
| C. | 分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟 | |
| D. | 铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体 |
7.在同温同压下,下列各组热化学方程式中,△H1>△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H1 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1 C(s)+O2(g)=CO2 (g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |