题目内容
2.下列反应属于氧化还原反应的是( )| A. | 2NaHCO3═Na2CO3+CO2↑+H2O | B. | MnO2+4 HCl(浓)═MnCl2+Cl2↑+2 H2O | ||
| C. | 2 H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2 H2O+O2↑ | D. | Na2CO3+CaCl2═CaCO3↓+2NaCl |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解:A.碳酸纳分解,元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.二氧化锰与浓盐酸反应,锰元素化合价降低,氯元素化合价升高,属于氧化还原反应,故B正确;
C.双氧水分解生成水和氧气,O元素化合价发生变化,属于氧化还原反应,故C正确;
D.为复分解反应,元素化合价没有发生变化,不属于氧化还原反应,故D错误.
故选BC.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
12.下列图示的装置可以构成原电池的是( )
| A. | 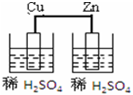 | B. | 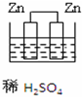 | C. | 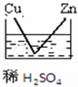 | D. |  |
13.在标准状况下,将11.2L的HCl溶于水配成0.5L盐酸,则所得溶液的浓度是( )
| A. | 1mol•L-1 | B. | 0.5mol•L-1 | ||
| C. | 22.4mol•L-1 | D. | 缺少密度无法计算 |
10.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法研究影响反应速率的因素.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
①用0.001mol•L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
| KMnO4酸性溶液的浓度 (mol•L-1) | 溶液褪色所需时间 (min) | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
7.常温下,下列各组离子能大量共存的是( )
| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |
14.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:2c(Ca2+)=c(NO3-) | |
| B. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子): c(Na+)>c(A-)>c(C1-)>c(OH-) | |
| C. | 0.1 mol/LNaAlO2溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
11.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
17.下列方程式书写正确的是( )
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |