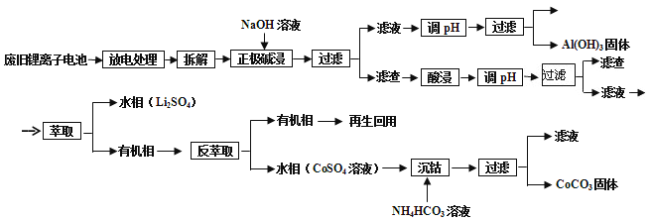
题目内容
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:

(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是 热反应, Ba(OH)28H2O与NH4Cl的反应是 热反应.反应过程 (填“①”或“②”)的能量变化可用图2表示。
(2)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
以上两个反应能设计成原电池的是 , 负极材料为:____ ___,电解质溶液为:_______ ___,负极的电极反应式为:_________________。
【答案】(1)放 吸 ①(2)B Cu FeCl3溶液 Cu-2e-=Cu2+
【解析】
试题分析:(1)实验中发现,反应后①中的温度升高, 由此判断铝条与盐酸的反应是放热热反应;, Ba(OH)28H2O与NH4Cl的反应温度降低,是吸热反应.图2表示放热反应,可表示反应①;(2)现有如下两个反应:氧化还原反应能设计成原电池的是,能设计成原电池的是2FeCl3+Cu=2FeCl2+CuCl2, 负极发生氧化反应,负极材料为Cu,电解质溶液为FeCl3,负极的电极反应式为:Cu-2e-=Cu2+。

练习册系列答案
相关题目