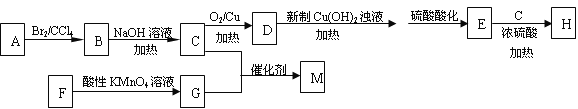
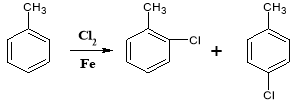
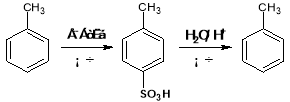
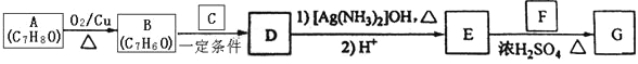题目内容
【题目】Ⅰ.化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳, 而氢气被认为是无碳无污染的清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2![]() MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。
MH2x △H<0 (M表示某种合金)右图表示温度分别为T1, T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是 。

a、T1>T2
b、增大氢气压强,加快氢气的吸收速率
c、增大M的量,上述平衡向右移动
d、上述反应可实现多次储存和释放氢气
(2)在25℃,101KPa条件下,ag氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 .
(3)工业上通常用生产水煤气的方法制得氢气。其中C(s) +H2O(g) ![]() CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
CO(g) + H2(g) ,在850℃时平衡常数K= 1.若向1升的恒容密闭真空容器中同时加入x mol C和6.0mol H2O.
①当加热到850℃,反应达到平衡的标志有 .
A.消耗水蒸气的物质的量与生成CO的物质的量相等 B.容器内的压强不变
C.混合气的密度不变 D.单位时间有n个H﹣O键断裂的同时有n个H﹣H键断裂
②850℃时反应达到平衡,x应满足的条件是 .
Ⅱ、甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题

(4)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如上图所示:通入b气体的电极是原电池的 极(填 “正”或“负”)。通入a气体的电极反应式为 。
(5)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示U形管中氯化钠溶液的体积为80ml。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (保留两位小数,已知法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。

【答案】Ⅰ.(1)bd;(2) H2(g)+1/2O2(g)=H2O(l),△H=﹣285.8/akJ/mol(3)① BC; ②x>2
Ⅱ.(4)正;CH3OH +H2O — 6e - == CO2 + 6H+(5) 7.72×103C; 14
【解析】
试题分析:(1)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1。a.T1<T2,故a错误;b.增大氢气压强,反应速率加快,氢气的吸收速率加快,故b正确;c.M为固体,增大M的量,浓度不变,上述平衡不移动,故c错误;d.金属储氢的原理可表示为:M(s)+xH2═MH2x(s)△H<0 平衡可以正向或逆向进行,反应可实现多次储存和释放氢气,故d正确;故答案为:bd;
(2)1g氢气完全燃烧生成液态水时放出142.9kJ热量,2g氢气燃烧生成液态水放热285.8KJ,则氢气燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol;故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol;故答案为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJ/mol;
(3)①C(s)+H2O(g)![]() CO(g)+H2(g),A.消耗水蒸气是正反应,生成CO也是正反应,故消耗水蒸气的物质的量与生成CO的物质的量相等不能作为判断是否达到平衡状态的依据,故A错误;B.反应前后气体的体积不等,故容器内的压强不变可作为判断是否达到化学平衡状态的依据,故B正确;C.密度=
CO(g)+H2(g),A.消耗水蒸气是正反应,生成CO也是正反应,故消耗水蒸气的物质的量与生成CO的物质的量相等不能作为判断是否达到平衡状态的依据,故A错误;B.反应前后气体的体积不等,故容器内的压强不变可作为判断是否达到化学平衡状态的依据,故B正确;C.密度=![]() ,总质量在变,体积不变,故混合气的密度不变可作为判断是否达到化学平衡状态的依据,故C正确;D.单位时间有n个H-O键断裂是正反应,同时有n个H-H键断裂是逆反应,但正逆反应速率不等,故单位时间有n个H-O键断裂的同时有n个H-H键断裂不能作为判断是否达到平衡状态的依据,故D错误,故答案为:BC;
,总质量在变,体积不变,故混合气的密度不变可作为判断是否达到化学平衡状态的依据,故C正确;D.单位时间有n个H-O键断裂是正反应,同时有n个H-H键断裂是逆反应,但正逆反应速率不等,故单位时间有n个H-O键断裂的同时有n个H-H键断裂不能作为判断是否达到平衡状态的依据,故D错误,故答案为:BC;
② C(s)+H2O(g)![]() CO(g)+H2(g),
CO(g)+H2(g),
开始(mol): 6 0 0
转化(mol): a a a
平衡(mol):6-a a a
K=![]() =1,a=2,故x应满足的条件是:x>2,故答案为:x>2;
=1,a=2,故x应满足的条件是:x>2,故答案为:x>2;
(4)燃料电池中,通入燃料的电极为负极,通入氧气的为正极,负极发生氧化反应,甲烷被氧化生成二氧化碳,电极方程式为,故答案为:正;CH3OH+H2O-6e-═CO2+6H+;
(5)电解氯化钠溶液的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=
2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=![]() =0.1mol/L,pH=13;电解池通过的电量为
=0.1mol/L,pH=13;电解池通过的电量为![]() ×8×9.65×104Cmol-1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),故答案为:7.72×103C;13。
×8×9.65×104Cmol-1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),故答案为:7.72×103C;13。