题目内容
12.中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组测定某葡萄酒中SO2含量.步骤如下:
(1)取300.00mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0mol•L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:(1)步骤2中H2O2 氧化SO2的化学方程式为SO2+H2O2=H2SO4.
(2)NaOH标准溶液用碱式(填“碱式或酸式”)滴定管盛装
(3)到达滴定终点时,溶液由无色变为浅红色,且半分钟内不再变化;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积④(填序号:①=10.00mL,②=40.00mL,③<10.00mL,④>40.00mL).
(5)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为0.24g•L-1.
(6)以下操作使所测得的SO2含量偏高的是A.
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确.
分析 (1)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的方程式;
(2)碱性溶液用碱式滴定管盛放;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,据此计算;
(5)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(6)根据n(H2SO4)=2n(NaOH)=2V(碱)×c(碱),分析不当操作对n(酸)的影响,以此判断SO2含量的变化.
解答 解:(1)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(2)碱性溶液用碱式滴定管盛放,则NaOH标准溶液用碱式滴定管盛放,故答案为:碱式;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性,以酚酞为指示剂,所以滴定到终点溶液由无色变为浅红色,故答案为:无;浅红;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确,
故答案为:④;
(5)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×0.0900mol/L×0.025L×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.072g}{0.3L}$=0.24g/L,
故答案为:0.24;
(6)A.滴定前,未用NaOH标准溶液润洗滴定管,则氢氧化钠的浓度减小,滴定时消耗的氢氧化钠偏多,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏大,则二氧化硫的物质的量偏大,即所测得的SO2含量偏高,故A正确;
B.滴定前滴定管内无气泡,终点读数时有气泡,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故B错误;
C.滴定前仰视读数,滴定终点时读数正确,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故C错误;
故答案为:A.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

| A. | PCl3→PCl5 | B. | MnO4-→Mn2+ | C. | SO2→SO32- | D. | FeCl3→FeCl2 |
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 丙烷的球棍模型为 | |
| C. | 乙醇含有的官能团是-OH,带一个单位负电荷 | |
| D. | 乙酸的分子式为C2H4O2,其中CH3-在溶液中能电离出H+ |
| A. | 刚开始醋酸与锌反应速率大 | |
| B. | 反应过程中盐酸和醋酸分别与锌反应的速率一样大 | |
| C. | 醋酸与锌反应放出的氢气多 | |
| D. | 锌分别与醋酸、盐酸反应产生的氢气一样多 |
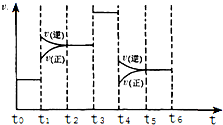 如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.| A | |||||||
| B | C | D | E | ||||
| F | G | H | |||||
(1)上述元素中地壳中极为丰富的元素O,单质中熔点最高的可能是C,E、F、G离子半径由小到大的顺序是Na+<F-<Cl-,写出化合物A2D2的电子式
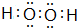 ;
;(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(3)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是t0~t1.温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为0.05mol/(L﹒s).
| A. | 加强汽车治理和垃圾处理场的建设和监管 | |
| B. | 实施“煤改气”、“煤改电”等清洁能源改造工程 | |
| C. | 研制新型高效可充电电池,发展纯电动汽车 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
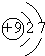 ,⑦元素的名称是硅,⑨元素的离子的电子式是
,⑦元素的名称是硅,⑨元素的离子的电子式是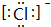 ,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”).
,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”).(2)在标号元素中,最活泼的金属元素是(写元素符号)Na.最活泼的非金属元素是(写元素符号)F.
(3)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是(写化学式)HCl.
(4)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是(写元素符号)Na>Al>Si.
(5)①与③形成共价化合物的电子式
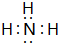 .用电子式表示⑤与⑧形成化合物的形成过程
.用电子式表示⑤与⑧形成化合物的形成过程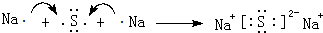 .
.(6)⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序是(写化学式)HClO4>H2SO4>H2SiO3.
| A. | 红宝石、蓝宝石的主要成分是Al2O3,石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 肌红蛋白、蚕丝、过氧化氢酶、鱼肝油充分水解后均可得到氨基酸 | |
| C. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种分散系,其分散剂为空气 | |
| D. | 二氧化碳、氨气、盐酸、食盐在一定条件下均能导电,但只有盐酸和食盐属于电解质,二氧化碳和氨气属于非电解质 |
| A. | 10ml 0.2mol/L的FeCl3溶液 | B. | 10ml 0.1mol/L的AlCl3溶液 | ||
| C. | 20ml 0.1mol/L的溶MgCl2液 | D. | 20ml 0.1mol/L的HCl溶液 |