题目内容
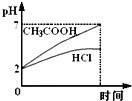
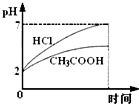
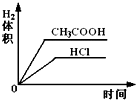
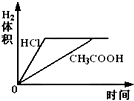
20.取pH=2的盐酸和醋酸各100毫升,再分别加入0.65克锌粉,在相同条件下充分反应后,有关叙述正确的是( )| A. | 刚开始醋酸与锌反应速率大 | |
| B. | 反应过程中盐酸和醋酸分别与锌反应的速率一样大 | |
| C. | 醋酸与锌反应放出的氢气多 | |
| D. | 锌分别与醋酸、盐酸反应产生的氢气一样多 |
分析 A、刚开始pH=2,氢离子的浓度相同,所以反应速率相等;
B、反应过程中醋酸是弱电解质,进程中一断电离产生氢离子,所以过程中醋酸提供的氢离子浓度大于盐酸;
C、n(Zn)=$\frac{0.65g}{65g/mol}$=0.01mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.01mol×2=0.02mol,pH=2、100mL盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸不足,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH=2的100mL醋酸中醋酸的物质的量大于盐酸,所以醋酸生成的氢气多;
D、由C的分析可知醋酸生成的氢气多.
解答 解:A、刚开始pH=2,氢离子的浓度相同,所以反应速率相等,故A错误;
B、反应过程中醋酸是弱电解质,进程中一断电离产生氢离子,所以过程中醋酸提供的氢离子浓度大于盐酸,所以反应过程中醋酸与锌反应的速率快,故B错误;
C、n(Zn)=$\frac{0.65g}{65g/mol}$=0.01mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.01mol×2=0.02mol,pH=2、100mL盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸不足,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH=2的100mL醋酸中醋酸的物质的量大于盐酸,所以醋酸生成的氢气多,故C正确;
D、由C的分析可知醋酸生成的氢气多,而不是一样多,故D错误;
故选C.
点评 本题考查了弱电解质的电离,首先根据酸、金属的量进行过量计算,然后根据弱电解质的电离特点来分析解答,很多同学往往不进行过量计算导致错误,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.某温度下,在固定容积容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,则( )
| A. | 平衡向正反应方向移动 | B. | 平衡向逆反应方向移动 | ||
| C. | 平衡不发生移动 | D. | 相对原平衡n(A)、n(B)减少,n(C)增大 |
4.下列解释事实的化学方程式或离子方程式,不正确的是( )
| A. | 工业上可用电解法制备Mg:MgCl2$\frac{\underline{\;熔融\;}}{电解}$ Mg+Cl2↑ | |
| B. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| C. | 等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- |
8.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g) 已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 生成l mol C的同时生成l mol D | D. | 气体的总物质的量 |
5.下列关于元素周期表和元素周期律的说法正确的是( )
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 | |
| B. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| C. | 第二周期元素从Li到F,非金属性逐渐减弱 | |
| D. | O与S为同主族元素,且O比S的非金属性弱 |
10.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1.0 mol•Lˉ1的醋酸溶液中CH3COOH和CH3COOˉ的总数为NA | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1mol Cu与足量浓硫酸反应生成SO2的体积约为2.24L | |
| D. | 2gCaCO3和8gKHCO3组成的混合物中碳原子数为0.1NA |