题目内容
7. 如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.
如表是元素周期表中短周期部分,表中所列字母分别代表一种元素.| A | |||||||
| B | C | D | E | ||||
| F | G | H | |||||
(1)上述元素中地壳中极为丰富的元素O,单质中熔点最高的可能是C,E、F、G离子半径由小到大的顺序是Na+<F-<Cl-,写出化合物A2D2的电子式
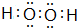 ;
;(2)A、B、D、F四种元素组成的受热易分解的化合物,写出少量该化合物溶液与足量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
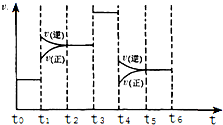
(3)化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示平衡混合物中CA3含量最高的一段时间是t0~t1.温度为T℃时,将4mol A2和2mol C2放入1L密闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为0.05mol/(L﹒s).
分析 由元素在周期表中位置,可知A为H、B为C、C为N、D为O、E为F、F为Na、G为Cl、H为Ar.
(1)地壳中氧元素含量第一;碳元素可以形成金刚石,为原子晶体,熔点最高;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;H2O2中氧原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对;
(2)H、C、O、Na四种元素组成的受热易分解的化合物,该化合物为NaHCO3,少量该化合物溶液与足量Ba(OH)2溶液反应生成碳酸钡沉淀、氢氧化钠与水;
(3)可逆反应3A2(g)+B2(g)?2BA3(g),△H=-92.4kJ•mol-1,该反应为体积减小的放热反应,改变反应条件(不改变A2、B2和BA3的量),根据各时刻的速率变化判断平衡移动移动方向,据此判断BA3的含量变化;
根据C2的转化率计算参加反应C2的物质的量,根据v=$\frac{△c}{△t}$计算v(C2),再利用速率之比等于化学计量数之比计算v(A2).
解答 解:由元素在周期表中位置,可知A为H、B为C、C为N、D为O、E为F、F为Na、G为Cl、H为Ar.
(1)上述元素中地壳中极为丰富的元素为氧;碳元素可以形成金刚石,为原子晶体,熔点最高;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Na+<F-<Cl-;H2O2中氧原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对,电子式为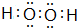 ;
;
故答案为:O;C;Na+<F-<Cl-;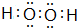 ;
;
(2)H、C、O、Na四种元素组成的受热易分解的化合物,该化合物为NaHCO3,少量该化合物溶液与足量Ba(OH)2溶液反应生成碳酸钡沉淀、氢氧化钠与水,反应离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,
故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O;
(3)化学反应3A2(g)+B2(g)?2BA3(g),△H=-92.4kJ•mol-1,该反应为体积减小的放热反应,
t0~t1,正逆反应速率相等,平衡不移动;
t1~t2,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动,导致氨气的含量降低;
t2~t3,正逆反应速率相等,处于平衡状态,氨气的含量不变;
t3~t4,正逆反应速率都同等程度的增大平衡不移动,氨气的含量不变;
t4~t5,正逆反应速率都降低,但逆反应速率大于正反应速率,导致平衡向逆反应方向移动,氨气的含量降低;
t5~t6,正逆反应速率相等,平衡不移动,氨气的含量不变;
所以平衡混合物中BA3的含量最高的一段时间是t0~t1,
60s后测得C2的转化率为50%,则参加反应C2的物质的量为2mol×50%=1mol,则v(C2)=$\frac{\frac{1mol}{1L}}{60s}$=$\frac{1}{60}$mol/(L.s),速率之比等于化学计量数之比,故v(A2)=3v(C2)=3×$\frac{1}{60}$mol/(L.s)=0.05mol/(L﹒s),
故答案为:t0~t1;0.05mol/(L﹒s).
点评 本题考查了元素周期表、离子半径比较、电子式、离子方程式、化学平衡图象、反应速率计算等,难点是根据图象中反应速率的变化判断平衡移动的方向.

| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| D. | 某溶液中先滴加足量稀盐酸,无明显变化,再滴加少量BaCl2溶液,生成白色沉淀,证明该溶液一定含有SO42- |
| A. | 该元素位于第七周期ⅥA族 | |
| B. | 该元素较易与氢结合为气态氢化物 | |
| C. | 该元素属于金属元素 | |
| D. | 该元素(R)最高价氧化物对应的水化物化学式为H2RO3 |
| A. | Be的原子半径小于B 的原子半径 | |
| B. | Be比Na金属性强 | |
| C. | Be的最高价氧化物对应水化物碱性弱于Ca(OH)2 | |
| D. | Be能跟冷水反应产生氢气 |
①缩小体积增大压强②降低温度③增大CO浓度④增加碳的量.
| A. | ①②③ | B. | ①③ | C. | ①②③④ | D. | ③④ |
| A. | 质子数为17,中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 硫离子的结构示意图: | |
| C. | 甲烷分子的比例模型: | |
| D. | 氯乙烯分子的结构简式:CH2-CH2Cl |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要 化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| B. | 元素X和Q形成的化合物中不可能含有共价键 | |
| C. | X、Z、M的单质分别与水反应,M最剧烈 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |