题目内容
14.甲醇低压羰基合成法(CH3OH+CO→CH3COOH)是当今世界醋酸生产的主要方法,国标优等品乙酸含量≥99.8%.为检验得到的乙酸中是否含有甲醇,可用的方法是( )| A. | 观察放入金属Na是否产生气泡 | |
| B. | 观察滴入的紫色石蕊溶液是否变红 | |
| C. | 观察滴入的酸性KMnO4溶液是否褪色 | |
| D. | 观察插入的表面发黑的灼热铜丝是否变红 |
分析 乙酸含-COOH,乙醇含-OH,均与Na反应,乙酸具有酸性,乙醇能被高锰酸钾氧化,以此来解答.
解答 解:A.均与Na反应生成气泡,不能检验,故A不选;
B.滴入的紫色石蕊溶液是否变红,可检验乙酸,不能检验乙醇,故B不选;
C.乙醇能被高锰酸钾氧化,使其褪色,则滴入的酸性KMnO4溶液是否褪色可检验乙醇,故C选;
D.乙酸与CuO反应,干扰乙醇与CuO的反应,不能检验,故D不选;
故选C.
点评 本题考查物质的检验实验,为高频考点,把握有机物的官能团与性质、性质差异为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
4.化学与人类生活、生成和社会可持续发展密切相关,下列说法正确的是( )
| A. | 铜矿石在细菌作用下直接转换为单质铜,这个过程中叫做生物炼铜 | |
| B. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,相同条件下,某物质的热值越高,其标准燃烧越大 | |
| C. | 铅蓄电池是最常见的二次电池,可根据硫酸的密度来判断铅蓄电池是否需要充电 | |
| D. | “地沟油”禁止食用,但可以通过物理变化制肥皂 |
2.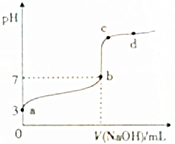 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中:c(H+)>c(CH3COO-)>c(OH-) | |
| B. | b点时,V(NaOH)=20mL | |
| C. | c点表示的溶液中:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) | |
| D. | d点表示的溶液中:c(Na+)>c(CH3COO-) |
9.如图是元素周期表中关于碘元素的信息,其中解读正确的是( )


| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
19.常温常压下,下列气体混合后压强一定不发生变化的是( )
| A. | NH3和Cl2 | B. | NH3和HBr | C. | SO2和O2 | D. | SO2和H2S |
6.常温下,运用电离理论做出的预测正确的是( )
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
3.下列有关实验操作、现象或结论的描述不正确的是( )
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
 .
.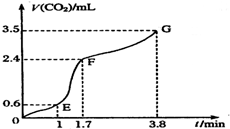 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: