题目内容
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
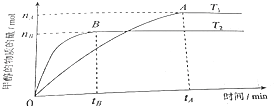
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
【答案】 后续“氧化”过程中加入的二氧化锰会氧化浓盐酸 MnO2+2Fe2++4H===Mn2++2Fe3++2H2O 0.05 Mn2++2HCO3===MnCO3↓+CO2↑+H2O 温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢 (NH4)2SO4 Mn2-2e+2H2O===MnO2+4H
【解析】菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、滤渣2为Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液3中含有硫酸铵、硫酸钠等。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是: 后续“氧化”过程中加入的二氧化锰会氧化浓盐酸。(2)“氧化”过程中加MnO2的目的:将亚铁氧化成铁离子,便于除去。用离子方程式表示MnO2+2Fe2++4H=Mn2++2Fe3++2H2O;(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,①Ksp[Fe(OH)3]=8.0×10-38=c(Fe3+)c3(OH-),②Ksp[Al(OH)3]=4.0×10-34=c(Al3+)c3(OH-),②比①式,解得:c(Al3+)= 0.05mol·L-1;(4)①“沉锰”过程中,MnCO3溶解度小,反应的离子方程式为Mn2++2HCO3=MnCO3↓+CO2↑+H2O。②当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是: 温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢;(5)从滤液3中含有硫酸铵、硫酸钠等,可分离出一种不含碳元素的氮肥,它的化学式为(NH4)2SO4。(6)电解时的阳极发生氧化反应,反应式为Mn2-2e+2H2O=MnO2+4H。

 阅读快车系列答案
阅读快车系列答案