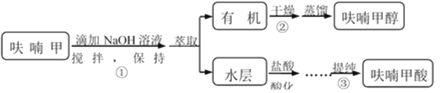
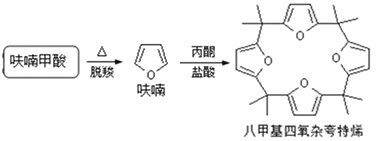
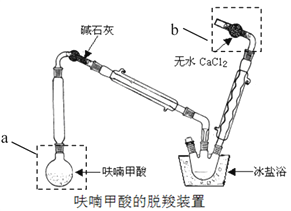
题目内容
【题目】将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程) 
(1)反应生成的气体的体积(标况下);
(2)反应过程中转移电子的物质的量;
(3)参加反应的稀硝酸的物质的量浓度.
【答案】
(1)解:
3Cu+ | 8HNO3(稀) | = | 3Cu(NO3)2+ | 2NO↑+ | 4H2O | 4H2O |
192g | 8mol | 44.8L | 6mol | |||
9.6g | n(HNO3) | V(NO) | n(e﹣) |
![]()
解之得:V(NO)=2.24L
(2)解: ![]()
解之得:n(e﹣)=0.3mol;
(3)解: ![]()
解之得:n(HNO3)=0.4mol;
所以c(HNO3)= ![]() =2mol/L;
=2mol/L;
【解析】硝酸具有强氧化性,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,根据反应方程式列出已知量与未知量的关系,由此分析解答.

练习册系列答案
相关题目