题目内容
12.在溶质物质的量相等的下列混合溶液中,反应先后顺序判断正确的是( )| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸:AlO2-、CO32-、HCO3-、OH- |
分析 A.氟气与水反应生成氟化氢和氧气,在溶液中不会与溴离子和氯离子反应;
B.难溶物越难溶,相同条件下优先生成沉淀;
C.离子的氧化性越强,优先与锌反应,离子的氧化性为:Fe3+>H+>Cu2+;
D.结合氢离子能力越强,优先与盐酸中的氢离子反应.
解答 解:A.向NaCl、NaBr、NaI混合溶液中通入F2,氟气与水反应生成氟化氢和氧气,不会与Br-、Cl-反应,故A错误;
B.溶解度:Ag2S<AgI<AgCl,溶解度越小,优先生成沉淀,则向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液,生成沉淀的先后顺序为:S2-、I-、Cl-,故B正确;
C.离子的氧化性为:Fe3+>H+>Cu2+,锌优先与氧化性较强的离子反应,所以与锌反应的先后顺序为:Fe3+、H+、Cu2+,故C错误;
D.NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸,氢氧化钠优先结合氢离子,其次是偏铝酸根离子,最后为碳酸根离子,即:OH-、AlO2-、CO32-、HCO3-,故D错误;
故选B.
点评 本题考查了氧化性、还原性强弱比较及其应用、化学反应先后顺序等知识,题目难度中等,注意掌握氧化还原反应中氧化性、还原性强弱的判断方法,明确化学反应进行的先后顺序的判断方法,A为易错点,注意氟气与水反应.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
2. 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
 阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )
阿斯巴甜(Aspartame,结构简式如图),具有清爽的甜味,甜度约为蔗糖的200倍.下列有关阿斯巴甜说法不正确的是( )| A. | 分子式为C14H18N2O3,属于蛋白质 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
3.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | KCl | C. | H2O | D. | NH4NO3 |
20.下列有机反应不属于取代反应的是( )
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 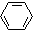 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$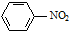 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$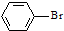 +HBr +HBr |
4.下列物质属于离子化合物的是( )
| A. | O2 | B. | H2O | C. | K2SO4 | D. | CH4 |
 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.