题目内容
17. 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:(1)甲烷是一种重要的清洁燃料,甲烷燃烧放出大量的热,可直接作为能源用人类生成和生活.
已知:
①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol;
请从化学反应的本质解释甲烷燃烧放出热量的原因:反应中形成新键时放出的能量大于断裂旧键时吸收的能量.
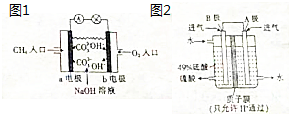
(2)在甲烷燃料电池中,甲烷的化学能利用率大大提高.如图1是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是a(天“a”或“b”)
②电池工作一段时间后电解质溶液的pH减小(填“增大”“减小”或“不变”)
(3)治理含二氧化硫的气体可利用原电池原理,用SO2和O2来制备硫酸,装置如图2,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
分析 (1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,利用盖斯定律来分析;化学反应的实质是旧键的断裂和新键的生成;
(2)①燃料电池中,通入燃料的电极是负极,;
②根据电池反应式确定溶液pH变化.
(3)本题为SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.
解答 解:(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,已知:
①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
根据盖斯定律,将$\frac{①+②}{2}$可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=$\frac{(-1214KJ/mol)+(-566KJ/mol)}{2}$=-890KJ/mol,即甲烷的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol;
化学反应的实质是旧键的断裂和新键的生成,旧键的断裂吸收能量,新键的形成放出能量,反应放热是因为形成新键时放出的能量大于断裂旧键时吸收的能量,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890KJ/mol;反应中形成新键时放出的能量大于断裂旧键时吸收的能量;
(2)①燃料电池中,通入燃料的电极是负极,故答案为:a;
②在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,溶液中氢氧根离子被消耗,导致溶液的pH减小,故答案为:减小.
(3)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
点评 本题考查热化学反应方程式的书写、原电池原理,注意原电池放电时,电解质溶液pH的变化情况,为易错点.

 名校课堂系列答案
名校课堂系列答案| A. | C3H8 | B. | C4H10 | C. | C5H8 | D. | C6H12 |
| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀盐酸:AlO2-、CO32-、HCO3-、OH- |
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:SO2+MnO2═MnSO4.
(2)浸出液的pH<2,从上述流程看,可能的原因为二氧化硫溶于水发生反应:SO2+H2O=H2SO3,生成的H2SO3部分电离:H2SO3?H++HSO3-(用化学用语和必要的文字说明).
(3)用离子方程式表示加入二氧化锰的作用:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.从表中数据来看,能不能取消“加入二氧化锰”的步骤?原因是不能,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀.
下列试剂能替代二氧化锰的是A(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点?简述理由:同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去.
(5)从含硫酸锰的滤液中提取硫酸锰晶体的操作是蒸发浓缩、降温结晶,过滤.利用滤渣能提取高纯度的铁红,简述其操作过程:将滤渣溶于足量的氢氧化钠溶液中,再进行过滤、洗涤、干燥,最后灼烧可得氧化铁.
 .
.