题目内容
17.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物( )| A. | Be(OH )2 | B. | Al(OH)3 | C. | NaOH | D. | RbOH |
分析 金属性越强,最高价氧化物对应水化物的碱性越强,碱性强弱介于KOH和Mg(OH)2之间,则中心元素的金属性介于K与Mg之间,再结合同主族自上而下金属性增强,同周期自左而右金属性减弱判断.
解答 解:Li、Na、K、Rb处于同主族,原子序数增大,则金属性Rb>K>Na>Li,Na、Mg、Al处于同周期,原子序数增大,则金属性Na>Mg>Al,故Na的金属性介于K、Mg之间,即NaOH的碱性介于KOH和Mg(OH)2之间,故选C.
点评 本题考查同主族、同周期元素金属性递变规律,难度不大,注意理解掌握元素周期律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.恒温条件下,把NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩,下列叙述正确的是( )
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,压强增大,且大于原来的2倍 |
5.如图a在金属活动性顺序表中排在氢之前,b为碳棒,下列说法不正确的是( )
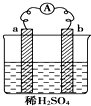

| A. | 反应后a极质量减小 | |
| B. | 碳棒上有气体逸出 | |
| C. | 导线上有电流,电子流动方向从a→b | |
| D. | a极上发生还原反应,b极上发生氧化反应 |
12.有两种主族元素X和Y,X元素的单质通常是黄色固体,X原子M电子层上的电子数为Y原子M电子层上的电子数的3倍,则X、Y的元素符号分别为( )
| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
9.下列离子方程式中,错误的是( )
| A. | 向AlCl3溶液中加入过量氨水:Al3++3 NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 向硝酸亚铁溶液中加入稀硫酸:3Fe2++NO3-+4H+═3Fe3++2H2O+NO↑ | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
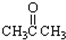 ③CH3CH2Br④
③CH3CH2Br④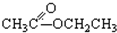 ⑤
⑤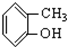 ⑥
⑥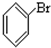 ⑦
⑦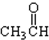 ⑧
⑧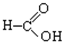 ⑨
⑨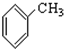 (10))
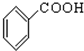
(10))
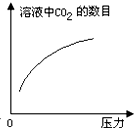
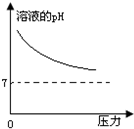
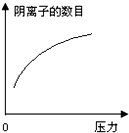
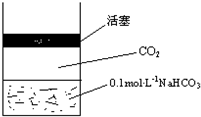 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )