题目内容
【题目】不属于四种基本反应类型的氧化还原反应的是( )
A.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Fe+CuSO4=Cu+FeSO4
D.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【答案】D
【解析】
根据题意可知,本题考查四大基本反应类型和氧化还原反应的区分,运用四大基本反应类型和氧化还原反应的分类标准分析。
A. A为分解反应,Mn和O元素化合价发生变化,属于氧化还原反应,A错误;
B. B为化合反应,Na和Cl元素化合价发生变化,属于氧化还原反应,B错误;
C. C为置换反应,Fe和Cu的化合价发生变化,属于氧化还原反应,C错误;
D. D中Fe和C的化合价发生变化,属于氧化还原反应,不属于四种基本反应类型,D正确。
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___,Zn的基态原子能级最高的电子的电子云轮廓图形状为___。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___mol,其阴离子中心原子的杂化方式是___,NH3的沸点高于PH3的原因是___。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
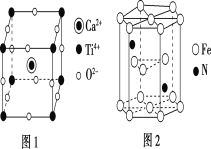
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm-3(列出计算式即可)。