题目内容
20.将6.4g铜与a ml 18.4mol•L-1的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:(要求有计算过程)(1)生成的SO2的体积(标准状况下).
(2)被还原的硫酸的物质的量.
(3)若用4mol•L-1的NaOH溶液吸收生成的SO2,恰好生成Na2SO3,计算需要NaOH溶液的体积.
分析 (1)根据电子转移守恒计算二氧化硫物质的量,再根据V=nVm计算二氧化硫的体积;
(2)被还原的硫酸生成二氧化硫,根据硫原子守恒计算被还原硫酸物质的量;
(3)根据守恒可知n(NaOH)=2n(Na2SO3)=n(SO2),再根据V=$\frac{n}{c}$计算需要NaOH溶液的体积.
解答 解:(1)6.4gCu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,根据电子转移守恒,二氧化硫物质的量为$\frac{0.1mol×2}{6-4}$=0.1mol,故二氧化硫的体积为0.1mol×22.4L/mol=2.24L,
答:标况下生成的SO2的体积为2.24L;
(2)被还原的硫酸生成二氧化硫,根据硫原子守恒,被还原硫酸物质的量等于二氧化硫的物质的量,故即被还原硫酸物质的量为0.1mol,
答:被还原硫酸物质的量为0.1mol;
(3)根据守恒可知n(NaOH)=2n(Na2SO3)=2n(SO2)=0.2mol,需要NaOH溶液的体积为$\frac{0.2mol}{4mol/L}$=0.05L,
答:需要氢氧化钠溶液体积为0.05L.
点评 本题考查化学方程式有关计算,比较基础,注意守恒法的运用,有利于基础知识的巩固.

练习册系列答案
相关题目
10.实验测得常温下0.1mol/L某一元酸(HA)溶液的pH不等于1,0.1mol/L某一元碱(BOH)溶液里:c(H+)/c(OH-)=10-12.将两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
| A. | c(B+)=c(A-)>c(OH-)>c(H+) | B. | c(A-)>c(B+)>c(H+)>c(OH-) | ||
| C. | c(B+)+c(H+)=c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
11.加热蒸干以下物质的溶液,不能析出原溶质固体的是( )
| A. | Al2(SO4)3 | B. | FeCl3 | C. | Na2CO3 | D. | KCl |
5.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol Fe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4混中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
9.有关下列图象的说法正确的是( )
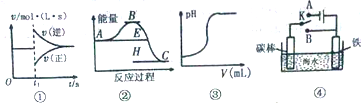

| A. | 图①可以表示,可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0维持温度、压强不变、t1时充入SO3(g) | |
| B. | 根据图②判断,物质A反应生成物C的△H>0 | |
| C. | 图③表示向一定量的氢氧人钠溶液中滴加一定浓度硫酸溶液时的pH变化 | |
| D. | 图④中开关K置于A或B处均可减缓铁的腐蚀 |
 (1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.
(1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼.请在下面方框中画出电解精炼铜的装置.