��Ŀ����
2������ⷨ����ҵ��þ���ɲ��ù��ȷ���Pidgeon�����������Ѱף�CaO•MgO��Ϊԭ�������������75%�Ĺ����Ͻ𣩻�������ܱջ�ԭ¯��1200���·�����Ӧ��2��CaO•MgO����s��+Si��s���TCa2SiO4 ��l��+2Mg��g����1����֪��ԭ�ԣ�Mg��Si��������Ӧ���ܷ�����ԭ����1200��ʱ��Ӧ���ɵ�þ����������ʽ�ݳ���ʹƽ��������Ӧ�����ƶ�
��2��ƽ����������������䣬����ԭ¯�����Сһ�룬��ﵽ��ƽ��ʱMg��g����Ũ�Ƚ����䣨����ߡ��������͡����䡰����
��3�����������Ӧ�����������ܱ������з���������Ӧ�ﵽƽ��ʱ������˵����ȷ����bc������ţ���
a����Ӧ�ﲻ��ת��Ϊ������
b��¯��Ca2SiO4��CaO•MgO�������ȱ��ֲ���
c��ƽ�ⳣ���������ֵ
d����λʱ���ڣ�n��CaO•MgO�����ģ�n��Ca2SiO4������=2��1��
���� ��1�����ݻ�ѧƽ���ƶ�ԭ�����ش�
��2������ͼ����Mg�IJ������¶ȵı仯���ǣ�����ƽ�ⳣ�����ж�Mg��g����Ũ�ȣ�
��3�����ݻ�ѧƽ��״̬����������������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ���������������Լ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯��һ������������Ӧ�ﵽ����ȣ�˵���ﵽ��ƽ��״̬��
��� �⣺��1��1200��ʱ������ӦΪ2��CaO•MgO����s��+Si��s��?Ca2SiO4 ��l��+2Mg��g������ʱþ����������ʽ�ݳ���ʹƽ��������Ӧ�����ƶ���ʹ�û�ѧ��Ӧ�ܷ������ʴ�Ϊ��1200��ʱ��Ӧ���ɵ�þ����������ʽ�ݳ���ʹƽ��������Ӧ�����ƶ���
��2����Ϊ�÷�Ӧ��K=C2��Mg����ƽ����������������䣬����ԭ¯�����Сһ�룬���¶�û������K���䣬������ƽ��ʱMg��g����Ũ�Ȳ��䣻
�ʴ�Ϊ�����䣻
��3��a����ѧƽ���Ƕ�̬ƽ�⣬��Ӧ�ﲻ��ת��Ϊ���������֤����Ӧ�����ģ��ʴ���
b��¯��Ca2SiO4��CaO•MgO�������ȱ��ֲ��䣬�ﵽ��ƽ�⣬����ȷ��
c��ƽ�ⳣ���������ֵ��˵��������ֵ�Ũ�Ȳ���ʱ��ı仯���ı䣬����ȷ��
d����λʱ���ڣ�n��CaO•MgO��������n��Ca2SiO4������=2��1������֤�����淴Ӧ������ȣ��ʴ���
��ѡbc��
���� ����Ŀ�ۺϿ��黯ѧ��Ӧ���ʵļ��㡢��ѧƽ��״̬���жϣ���һ��֪ʶ�����Ӧ����Ŀ��ע�������������ǹؼ����Ѷȴ�

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д���2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=3.8��10 -9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ4��10 -4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ3.8��10-5mol/L��
�����¶�t���£�ijBa��OH��2��ϡ��Һ��c��H+��=10-amol/L��c��OH-��=10-bmol/L����֪a+b=12�������Һ����μ���pH=b��NaHSO4����û����Һ�IJ���pH���±���ʾ��
| ��� | ����������Һ�����/mL | ����������Һ�����/mL | ��Һ��pH |
| �� | 33.00 | 0.00 | 8 |
| �� | 33.00 | x | 7 |
| �� | 33.00 | 33.00 | 6 |
��2�������¶��µ�Ba��OH��2��Һȡ��1ml����ˮϡ����1L�����ϡ�ͺ����Һ��c��Ba2+���sc��OH-��=1��20��
��3����NaHSO4��ͬ��NaHSO3 ��NaHCO3ҲΪ��ʽ�Σ���֪NaHSO3��Һ�����ԡ�NaHCO3��Һ�ʼ��ԣ�����Ũ�Ⱦ�Ϊ0.1mol•L-1��NaHSO3��Һ��NaHCO3��Һ����Һ�и����ӵ����ʵ���Ũ�ȴ������й�ϵ��R��ʾS��C�������п�����ȷ����AC������ĸ��
A��c��Na+����c��HRO3-����c��H+����c��RO32-����c��OH-��
B��c��Na+��+c��H+��=c��HRO3-��+c��RO32-��+c��OH-��
C��c��H+��+c��H2RO3��=c��RO32-��+c��OH-��
D������Һ��c��Na+����c��HRO3-����c��RO32-���ֱ���ȣ�
| A�� | ���� | B�� | ���� | C�� | ���� | D�� | ����ƾ� |
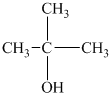 ��
��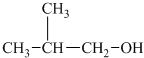 ��
�� ��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������
��CH3CH2CH2CH2OH���ܱ������ɺ���̼ͬԭ������ȩ���ǣ�������| A�� | �٢� | B�� | ֻ�Т� | C�� | �٢� | D�� | �ڢ� |
| A�� | A | B�� | B | C�� | C | D�� | D |
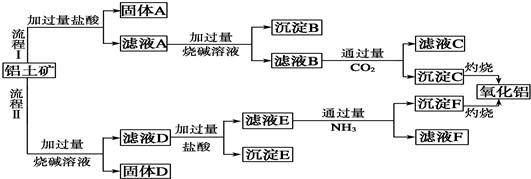
 ��1��ͨ����ұ��������ͭ�Ǵ�ͭ�������ʶ࣬������е�⾫�����������淽���л�����⾫��ͭ��װ�ã�
��1��ͨ����ұ��������ͭ�Ǵ�ͭ�������ʶ࣬������е�⾫�����������淽���л�����⾫��ͭ��װ�ã�