题目内容
【题目】甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)CH3OH(g)的△H═ _________.
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________(结果保留小数点后两位数字)
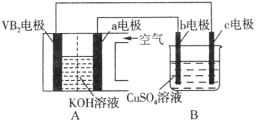
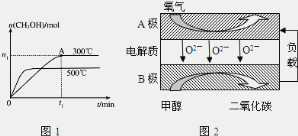
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4molL﹣1的草酸钾溶液10ml,能否产生沉淀__________(填“能”或“否”).
【答案】(1)△H=△H1+![]() △H2 ﹣
△H2 ﹣![]() △H3
△H3
(2)<
(3)A B E
(4)6.75
(5)CH3OH+3O2﹣﹣6e﹣=CO2+2H2O
(6)否
【解析】
试题分析:(1)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1 ,②2CO(g)+O2(g)=2CO2(g)△H2,③2H2(g)+O2(g)=2H2O(g)△H3,据盖斯定律,①+![]() ×②﹣
×②﹣![]() ×③得CO(g)+2H2(g)CH3OH(g)的△H=△H1+
×③得CO(g)+2H2(g)CH3OH(g)的△H=△H1+![]() △H2 ﹣
△H2 ﹣![]() △H3。
△H3。
(2)在300℃到500℃时,CH3OH的物质的量减小,说明平衡逆向移动,逆反应是吸热反应,则该反应的正反应是放热反应,即△H<0.
(3)A.缩小容器体积,增大压强,平衡正向移动,甲醇的产率增加,正确;B.降低温度,平衡正向移动,甲醇的产率增加,正确;C.升高温度,平衡逆向移动,甲醇的产率减少,错误;D.使用合适的催化剂,平衡不移动,错误;E.将甲醇从混合体系中分离出来,有利平衡正向移动,提高甲醇的产量,正确;答案选ABE。
(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,
CH4 + H2O CO + 3H2
起始物质的量浓度(molL﹣1) 1.0 1.0 0 0
转化物质的量浓度(molL﹣1) 0.5 0.5 0.5 1.5
平衡物质的量浓度(molL﹣1 0.5 0.5 0.5 1.5
K=![]() =
=![]() =6.75mol2/L2;
=6.75mol2/L2;
(5)根据原电池原理,负极上甲醇失电子生成二氧化碳,电极反应为:CH3OH+3O2﹣﹣6e﹣=CO2+2H2O
(6)碳酸钙溶液中钙离子浓度=![]() mol/L=5×10﹣5mol/L,二者混合后,钙离子浓度=2.5×10﹣5mol/L,草酸钾浓度为4.0×10﹣4mol/L,混合后c(Ca2+)c(C2O42﹣)=2.5×10﹣5 ×4.0×10﹣4=1×10﹣8<Ksp(4.0×10﹣8),所以无沉淀。
mol/L=5×10﹣5mol/L,二者混合后,钙离子浓度=2.5×10﹣5mol/L,草酸钾浓度为4.0×10﹣4mol/L,混合后c(Ca2+)c(C2O42﹣)=2.5×10﹣5 ×4.0×10﹣4=1×10﹣8<Ksp(4.0×10﹣8),所以无沉淀。

 阅读快车系列答案
阅读快车系列答案【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。