��Ŀ����
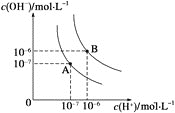
����Ŀ��(1)ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100 ��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���100 ��ʱ1 mol��L��1��NaOH��Һ�У���ˮ�������c(H��)________mol��L��1��Kw(25 ��)________Kw(100 ��)(����>������<����������)��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ����________(�����ٽ�������������������Ӱ����)��
(2)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݡ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10-10 |
CH3COOH | K=1.8��10-5 |
H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
��25 ��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ_____________________________��
��25 ��ʱ����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ�������Һ�Լ��ԣ���c(Na��)______c(CH3COO��)(����>������<����������)��
����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_______________��
���𰸡�1��10��12 < �ٽ� Na2CO3>NaCN>CH3COONa > NaCN��H2O��CO2===HCN��NaHCO3
��������
(1)Kw=c(H+)c(OH-)���¶Ȳ�ͬ��Kw��ͬ�����´ٽ�ˮ�ĵ��룬������Ũ������ˮ����δٽ�ˮ�ĵ��룻
(2)��������ĵ��볣����������жϣ���Խ�����룬��Ӧ��ˮ��̶�ԽС��
��������Һ�е���غ���������
�����ݵ��볣����С������Ӧ���ɲ��
(1)25��ʱ��ˮ��c(H+)=c(OH-)=10-7 mol/L��Kw=c(H+)c(OH-)=10-14 �����¶����ߵ�100������ˮ��c(H+)=c(OH-)=10-6 mol/L��Kw=c(H+)c(OH-)=10-12 ��100��ʱ1molL-1��NaOH��Һ��Kw=c(H+)c(OH-)=10-12 ��c(OH-)=1mol/L��ˮ�������c(H+)=1��10-12��ˮ�ĵ���ʱ���ȹ��̣����ȴٽ�����������Ũ�Ⱥ�����������Ũ������Kw��������Kw(25��)��Kw(100��)��NH4Cl�����ܽ����Һ��笠�����ˮ������һˮ�ϰ��������ӣ���Һ�����ԣ�ˮ�ĵ��뱻�ٽ���
(2)������ͼ�����ݷ�����������볣�������������̼��������ӣ����Ե�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һˮ��̶ȵ�Ũ�ȵ�Na2CO3��Һ��NaCN��Һ��CH3COONa��Һ����ҺpHΪNa2CO3��Һ�ģ�NaCN��Һ�ģ�CH3COONa��Һ�ģ�
����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ��õ���������Һ��������Һ�Լ��ԣ�c(H+)��c(OH-)��������Һ�е���غ�c(H+)+c(Na+)=c(OH-)+c(CH3COO-)��c(Na+)��c(CH3COO-)��
����NaCN��Һ��ͨ������CO2 ��HCN���Դ���HCO3-����С��H2CO3�����Է�Ӧ���������̼�����ƣ��������ɶ�����̼����Ӧ�Ļ�ѧ����ʽΪ��NaCN+H2O+CO2=HCN+NaHCO3��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�