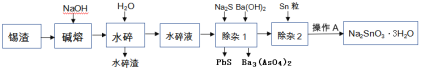
题目内容
【题目】某化学小组同学在学习Cl2的实验室制法后,发现用加热浓盐酸与MnO2合物的方法制Cl2既浪费能源又不易控制温度,他们现欲对该实验进行改进并验证Cl2的部分性质,进行了如下探究活动。
查阅资料:KMnO4和KClO3的氧化性都比MnO2强,在不加热的条件下均可与浓盐酸发生反应,从而实现制取Cl2的目的。
(1)确定反应原理:![]() __________________
__________________![]()
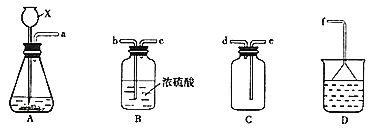
(2)选择实验装置:现有如图所示的装置,可以选择其中的__________________(填序号)进行实验。

(3)装置的正确连接顺序为__________________(用小写字母序号表示)。
(4)①实验时C中所装液体是__________________。
②在制氯气前,必须进行的一项操作是__________________。
③D中所装液体是__________________。
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色退去。小组内有甲、乙两种意见。
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液退色。
乙:氯气溶于水生成漂白性物质,使溶液退色。
某同学在退色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未显红色,说明_________(填“甲”或“乙”)正确。
【答案】![]() ABCDEGH a→d→e→b(c)→c(b)→g→h→i→j→k→l→f 饱和食盐水 检查装置的气密性 NaOH溶液 乙
ABCDEGH a→d→e→b(c)→c(b)→g→h→i→j→k→l→f 饱和食盐水 检查装置的气密性 NaOH溶液 乙
【解析】
(1)由原子守恒可知,产物中有KCl和MnCl2,配平化学方程式,填入的物质为2KCl+2MnCl2;
(2)KMnO4和浓盐酸反应为固液制备气体的反应,且不需要加热,则反应装置选A,Cl2中含有HCl和H2O,除去HCl,用饱和食盐水溶液洗气,选择装置C,利用装置B干燥,H用于收集氯气,而E和G用于性质验证实验,D用于尾气吸收,综上需要装置包括了ABCDEGH;
(3)装置的正确连接顺序:发生装置→净化装置→性质检验装置→收集装置→尾气处理装置,再净化装置中,先除去HCl,再干燥除水;收集时,由于Cl2的密度大于空气,应该长导管进,则排序为a→d→e→b(c)→c(b)→g→h→i→j→k→l→f;
(4)C的作用是除去挥发出的HC1气体,则C中为饱和食盐水。在制取气体前,应该先检查装置的气密性。吸收多余的Cl2可用NaOH溶液;
(5)因在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液中有酚酞,碱性溶液应显红色,但溶液一直未显红色,说明氯气溶于水生成漂白性物质,使溶液褪色,则乙正确。

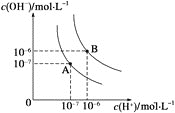
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。
【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。