题目内容
【题目】根据下列要求,回答问题:
(1)现有下列物质:①氢氧化钾固体;②稀硫酸;③铜片;④蔗糖(![]() )固体;⑤熔融的氯化钠。其中属于电解质的是__________(填序号)。
)固体;⑤熔融的氯化钠。其中属于电解质的是__________(填序号)。
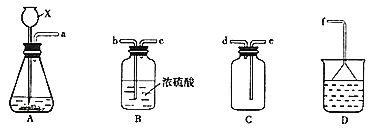
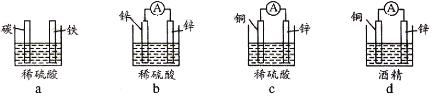
(2)下列装置能构成原电池的是__________(填写字母序号)。
(3)在2A+B![]() 2C+D反应中,表示该反应最快的是__________(填写字母序号)。
2C+D反应中,表示该反应最快的是__________(填写字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(4)甲烷的燃烧热![]() ,则甲烷燃烧的热化学方程式可表示为_______。
,则甲烷燃烧的热化学方程式可表示为_______。
(5)90℃时,![]() 一元酸HA与
一元酸HA与![]() NaOH溶液等体积混合后,混合液的pH为7,则溶液中所有离子的浓度由大到小的顺序是_________________________________。
NaOH溶液等体积混合后,混合液的pH为7,则溶液中所有离子的浓度由大到小的顺序是_________________________________。
【答案】①⑤ c d ![]()
![]()
![]()
【解析】
在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析解答第(2)小问;比较反应速率快慢,必须化为同一种物质为基准比较;根据燃烧热的概念,写出热化学方程式;酸碱中和时,90℃时,pH为7的溶液显碱性,再由电荷守恒可推出离子浓度大小。
(1)①氢氧化钾固体、⑤熔融的氯化钠在水溶液里或熔融状态下都能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质,②稀硫酸是混合物,不是电解质,③铜片是单质,不是电解质,④蔗糖 (C12H22O11) 固体在水溶液或熔融状态下以分子存在,所以其水溶液和熔融状态都不导电,为非电解质;答案为①⑤。
(2)a. 该装置不能形成闭合回路,所以不能构成原电池,故a错误;
b.该装置的两个电极材料相同,所以不能构成原电池,故b错误;
c.该装置符合原电池的构成条件,属于原电池,故c正确;
d.该装置不能自发进行氧化还原反应,所以不能构成原电池,故d错误;
答案为c。
(3)同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,先把不同物质的反应速率换算成同一物质的反应速率进行比较,都转化为用物质B表示化学反应速率;
a.![]() ,反应速率之比等于其计量数之比,所以v(B)=
,反应速率之比等于其计量数之比,所以v(B)= ![]() v(A)=0.4mol·L-1·s-1;
v(A)=0.4mol·L-1·s-1;
b.![]() ;
;
c.![]() ;反应速率之比等于其计量数之比,所以v(B)=
;反应速率之比等于其计量数之比,所以v(B)=![]() v(C)=0.3 mol·L-1·s-1;
v(C)=0.3 mol·L-1·s-1;
d.![]() ;反应速率之比等于其计量数之比,所以v(B)=v(D)=0.5 mol·L-1·s-1;所以反应速率最快的是d;
;反应速率之比等于其计量数之比,所以v(B)=v(D)=0.5 mol·L-1·s-1;所以反应速率最快的是d;
答案为d。
(4)因燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,一般H→H2O(l),C→CO2,由热化学方程式的书写方法可知甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1;答案为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1。
(5)![]() 一元酸HA与
一元酸HA与![]() NaOH溶液等体积混合后,溶液中有四种离子,Na+、A-、OH-、H+,根据溶液中电荷守恒得c(Na+)+ c(H+)= c(A-)+ c(OH-),90℃时,pH为7的溶液显碱性,则c(OH-)>c(H+),推出c(Na+)>c(A-),则c(Na+)>c(A-)>c(OH-)>c(H+);答案为c(Na+)>c(A-)>c(OH-)>c(H+)。
NaOH溶液等体积混合后,溶液中有四种离子,Na+、A-、OH-、H+,根据溶液中电荷守恒得c(Na+)+ c(H+)= c(A-)+ c(OH-),90℃时,pH为7的溶液显碱性,则c(OH-)>c(H+),推出c(Na+)>c(A-),则c(Na+)>c(A-)>c(OH-)>c(H+);答案为c(Na+)>c(A-)>c(OH-)>c(H+)。

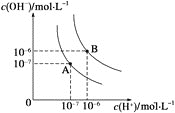
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。
【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。