题目内容
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1∶1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
A.①③⑥⑧B.③⑦⑧
C.②⑤⑥⑦D.①④⑧
【答案】B
【解析】
①Na2O2中有1个O22-和2个Na+,阴、阳离子个数比为1:2,①错误;
②![]() ,
,![]()
![]() ,产生等量氧气,需要
,产生等量氧气,需要![]() 和
和![]() 的物质的量相等,但由于摩尔质量不等,故质量不等,②错误;
的物质的量相等,但由于摩尔质量不等,故质量不等,②错误;
③每产生![]() 转移电子为
转移电子为![]() ,产生氧气的量相等,转移电子相等,③正确;
,产生氧气的量相等,转移电子相等,③正确;
④Na2O2漂白是利用其强氧化性,而SO2漂白是由于结合有色物质生成了不稳定的无色物质,原理不相同,④错误;
⑤Na2O2具有强氧化性,能氧化SO2,![]() ,⑤错误;
,⑤错误;
⑥Na2O2能与酸反应生成盐、水和氧气,过氧化钠属于过氧化物,⑥错误;
⑦![]() ,Na2O2中氧的化合价既升高又降低,Na2O2既是氧化剂,又是还原剂,⑦正确;
,Na2O2中氧的化合价既升高又降低,Na2O2既是氧化剂,又是还原剂,⑦正确;
⑧![]() ,溶液呈碱性,故变蓝,但由于Na2O2强氧化性,能漂白,故褪色,⑧正确;
,溶液呈碱性,故变蓝,但由于Na2O2强氧化性,能漂白,故褪色,⑧正确;
综上,正确的为③⑦⑧。
答案选B。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
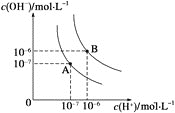
金牌教辅培优优选卷期末冲刺100分系列答案【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。