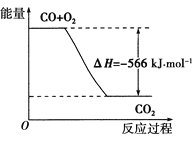
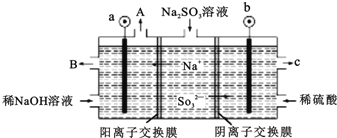
题目内容
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是 ______ ;
(2)该反应的还原产物是 ______ ;
(3)1 mol氧化剂在反应中得到电子的物质的量为 ______ ;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目。
_________NaBiO3+_____ ________ + _____ ________→_____ _______ + ______ ________+ ______ _______+ ______ _______。
_____________
【答案】Cu(IO3)2 CuI、I2 11 mol 10 4 MnSO4 14 H2SO4 5 Bi2(SO4)3 4 NaMnO4 3 Na2SO4 14 H2O 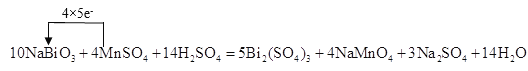
【解析】
(1)~(3)Cu(IO3)2与KI在硫酸酸化条件下反应产生I2,CuI沉淀,同时得到K2SO4、H2O,根据氧化剂得到电子,元素化合价降低,还原剂失去电子,元素化合价升高,元素化合价升降数目等于1 mol物质失去或得到的电子数目;
(4)从NaBiO3是反应物开始分析,另一种含有铋的化合物Bi2(SO4)3是生成物,Bi化合价降低,则反应物NaBiO3作氧化剂,则MnSO4为反应物,NaMnO4为生成物,生成物中的SO42-由H2SO4提供,则H2SO4是反应物,结合元素守恒,生成物中还有Na2SO4、H2O。
(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有I2生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂;
(2)该反应中Cu(IO3)2得电子生成CuI、I2,所以还原产物是CuI、I2;
(3)Cu(IO3)2在反应中作氧化剂,根据氧化剂中所含有元素化合价降低的数值等于其反应中得到电子数目,可知1 mol Cu(IO3)2得到电子数目为[(2-1)+(5-0)×2]×1 mol=11 mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4、H2O。因此该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,得到4个电子,反应中得失电子的最小公倍数为20,则其化学反应方程式为![]() ;用单线桥法表示电子转移为:
;用单线桥法表示电子转移为: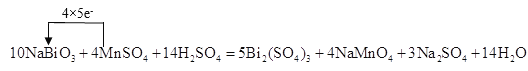 。
。

 口算能手系列答案
口算能手系列答案【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。