��Ŀ����
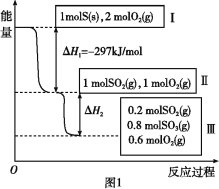
����Ŀ�����º���������,����Է�������ת��,�䷴Ӧ���̺�������ϵ��ͼ1��ʾ��
��֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-196.6 kJ/mol��
2SO3(g) ��H=-196.6 kJ/mol��
��ش��������⣺
��1��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2��״̬II��״̬III�ų�������Ϊ ��
��3�����º���ʱ,1 mol SO2��2 mol O2��ַ�Ӧ,�ų���������ֵ���O��H2�O (������������С�����������)��
��4�������еĻ������ͨ��������NaOH��Һ������NaOH�����ʵ���Ϊ ������Һ�з�����������ԭ��Ӧ,��ù��̵����ӷ���ʽΪ�� ��
��5������������,���д�ʩ����ʹn(SO3)/ n(SO2)������� ��
A�������¶�
B������He��
C���ٳ���1 mol SO2(g)��1 mol O2(g)
D��ʹ�ô���
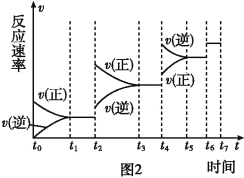
��6��ijSO2(g)��O2 (g)��ϵ��ʱ��t1�ﵽƽ��ı�ijһ�����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ�������ı�SO2(g)��O2(g)��������ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������SO3�ĺ�����ߵ�һ��ʱ���� ��
���𰸡���1��S(s)+O2(g)= SO2(g) ��H=-297 kJ/mol
��2��78.64 kJ
��3����
��4��2 mol��2SO2+O2+4OH-=2SO42- +2H2O
��5��c
��6�������¶���t3��t4
��������
�����������1��ȼ������ָ1mol��ȼ����ȫȼ�������ȶ���������ų���������������������ʵ���Ϊ1mol����ͼ1��֪1molS(s)��ȫȼ�շų�������Ϊ297KJ�����������ȼ���ȵ��Ȼ�ѧ����ʽS(s)+O2(g)�TSO2(g)��H=-297KJmol-1���ʴ�Ϊ��S(s)+O2(g)�TSO2(g)��H=-297KJmol-1
��2������ͼ1��֪���μӷ�Ӧ��n(SO2)=1mol-0.2mol=0.8mol�������Ȼ�ѧ����ʽ��2SO2(g)+O2(g)![]() 2SO3(g)��H=-196.6KJmol-1����֪����H2 = 0.4��H = 0.4 �� (=-196.6KJmol-1)=-78.64KJmol-1���ʴ�Ϊ��78.64KJmol-1��
2SO3(g)��H=-196.6KJmol-1����֪����H2 = 0.4��H = 0.4 �� (=-196.6KJmol-1)=-78.64KJmol-1���ʴ�Ϊ��78.64KJmol-1��
��3�����º���ʱ����ʼΪ1molSO2��2molO2�뿪ʼΪ1molSO2��1molO2��ȣ�����������Ũ�ȣ�ƽ�������ƶ������Կ�ʼΪ1molSO2��2molO2��SO2ת���ʸߣ��ų���������ֵ��|��H2|�ʴ�Ϊ����
��4����Ӧ���õ������ƣ�������ԭ�ӡ���ԭ��ԭ���غ㣬n(NaOH)=2n(S)=2��(0.2+0.8)mol=2mol��������������ԭ��Ӧ������SO2��O2���������ӷ���ʽΪ2SO2+O2+4OH-�T2SO42-+2H2O���ʴ�Ϊ��2mol��2SO2+O2+4OH-�T2SO42-+2H2O��
��5��a����ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���n(SO3)��С��n(SO2)����n(SO3)/n(SO2)��С����a����b�����������£����뺤������Ӧ�����Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���n(SO3)/n(SO2)���䣬��b����c���ٳ���1molSO2(g)��1molO2(g)����ЧΪ��ѹǿ����һ����ƽ�������ƶ���n(SO3)/n(SO2)����c��ȷ��d��ʹ�ô������ӿ췴Ӧ��ƽ�ⲻ�ƶ���n(SO3)/n(SO2)���䣬��d���ʴ�Ϊ��c
��6��t2��t3���������ʶ��ӿ죬��v(��)��v(��)��ƽ�������ƶ���t4��t5���������ʶ��ӿ죬��v(��)��v(��)��ƽ�������ƶ����÷�ӦΪ�����С�ķ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���������ѹǿ��ƽ�������ƶ�����t2��t3��Ϊ����ѹǿ��t4��t5��Ϊ�����¶ȣ�t2��t3��Ϊ����ѹǿ��ƽ�������ƶ���SO3�ĺ������ߣ���t3��t4ƽ��ʱ��������ߣ��ʴ�Ϊ�������¶ȣ�t3��t4��

����Ŀ����C��ѧ����ָ��̼���ʻ�����к�1��̼ԭ�ӵ����ʣ���CO��CO2��CH4��CH3OH�ȣ�Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ���գ��Կ�������Դ�Ϳ��ƻ�����Ⱦ����Ҫ���塣
��1��һ���¶��£��������ݻ���Ϊ2 L���ܱ������У��ֱ�����Ӧ��CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ��H����49.0 kJ/mol������������£�
CH3OH(g) + H2O(g) ��H����49.0 kJ/mol������������£�
���� | �� | �� |
��Ӧ��Ͷ���� | 1 mol CO2(g)��3 mol H2(g) | 1 mol CH3OH(g)��1 mol H2O(g) |
ƽ��ʱc(CH3OH) | c1 | c2 |
ƽ��ʱ�����仯 | �ų�29.4 kJ | ����a kJ |
��ش���c1 c2�����������������������a�� ��
�������з�Ӧ�ﵽƽ����ʱ10 s������CO2����ʾ���з�Ӧ�ӿ�ʼ��ƽ������е�ƽ����Ӧ������_____mol/(L��s)��
��2�������Ϊ1 L���ܱ������г���b mol CO��2b mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ��ʱCO��ת�������¶ȵĹ�ϵ��ͼ��ʾ����ش��������⣺
CH3OH(g)��ƽ��ʱCO��ת�������¶ȵĹ�ϵ��ͼ��ʾ����ش��������⣺

������Ӧ���� ��������š����ȷ�Ӧ��
��100��ʱ���÷�Ӧ��ƽ�ⳣ��K�� ���ú�b�Ĵ���ʽ��ʾ����
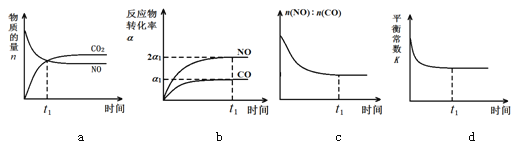
��3����������β���ķ�Ӧ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H��0���ں��º��ݵ��ܱ�������ͨ��n(NO):n(CO)��1:2�Ļ�����壬����������Ӧ������ͼ����ȷ����˵����Ӧ�ڽ��е�t1ʱ��һ���ﵽƽ��״̬���� ��ѡ����ĸ��
2CO2(g)+N2(g) ��H��0���ں��º��ݵ��ܱ�������ͨ��n(NO):n(CO)��1:2�Ļ�����壬����������Ӧ������ͼ����ȷ����˵����Ӧ�ڽ��е�t1ʱ��һ���ﵽƽ��״̬���� ��ѡ����ĸ��