题目内容
【题目】二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
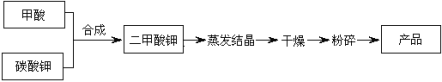
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
【答案】(1)4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O
(2)①酚酞 溶液由无色恰好变成浅红色且在半分钟内不褪色②96.2%
【解析】
试题分析:(1)甲酸与碳酸钾反应生成二甲酸钾酸式盐,根据质量守恒定律,产物中还有二氧化碳、水,所以化学方程式为4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O;
(2)①终点时氢氧化钠与二甲酸钾恰好完全反应生成正盐,甲酸是弱酸,所以其正盐水解溶液为碱性,故使用在碱性条件下变色的酚酞做指示剂;终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色;
②二甲酸钾与氢氧化钠溶液反应的化学方程式为2KH(HCOO)2+ 2NaOH=K2(HCOO)2 +Na2(HCOO)2+2H2O,则n(KH(HCOO)2)= n(NaOH)= 18.50×10-3L×0.10mol/L=1.85×10-3mol,所以产品中二甲酸钾的质量分数为1.85×10-3mol×130g/mol×10÷2.5g×100%=96.2%。。

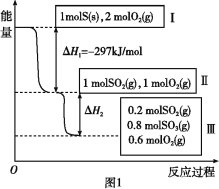
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
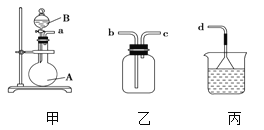
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。

【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:________________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)D→A所加试剂及反应条件为____________________;反应类型为__________________;
(5)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。