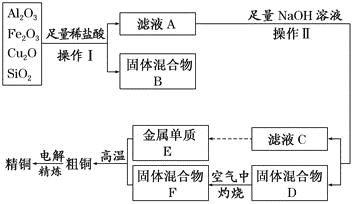
题目内容
【题目】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
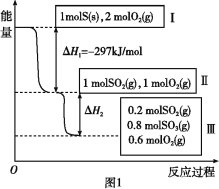
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
请回答:①c1 c2(填“>”、“<”或“=”);a= 。
②若甲中反应达到平衡耗时10 s,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(2)向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:
CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:

①正反应属于 (填“吸”或“放”)热反应。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
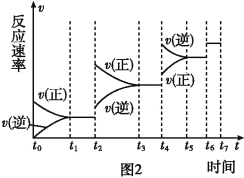
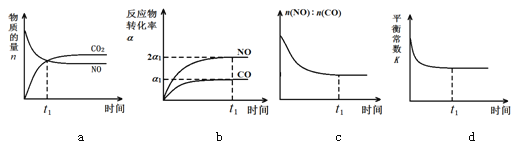
(3)治理汽车尾气的反应是2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
【答案】(1)①=,19.6;②0.03;(2)①放;②![]() ;(3)b c。
;(3)b c。
【解析】
试题分析:(1)①因为条件是等温等压,且乙转化到同一半边,投入量和甲相同,两个平衡为等效平衡,即c1=c2;②放出29.4kJ的热量消耗n(CO2)=29.4/49mol=0.6mol,根据化学反应速率的数学表达式,v(CO2)=0.6/(2×10)mol/(L·s)=0.03 mol/(L·s);(2)①随着温度的升高CO的转化率降低,根据勒夏特列原理,正反应属于放热反应;②100℃是CO的转化率为0.5,消耗的n(CO)=0.5b,平衡时n(CO)=(b-0.5b)mol=0.5bmol,,则达到平衡时,n(H2)=(2b-2×0.5b)mol=bmol,n(CH3OH)=0.5b,根据化学平衡常数的定义,K=1/b2;(3)a、根据化学平衡状态的定义,各组分的浓度保持不变,而不是相等,故错误;b、根据化学平衡状态的定义,故正确;c、根据化学平衡状态定义,当组分的浓度不再改变,达到平衡,物质的量之间的比值也不再改变,故正确;d、平衡常数只受温度的影响,温度不变平衡常数不变,故错误。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2[ | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。