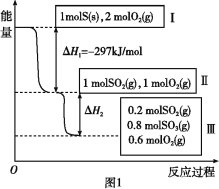
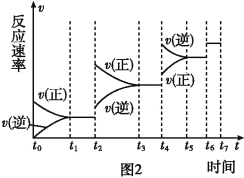
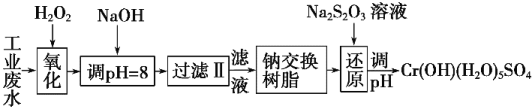
��Ŀ����
����Ŀ����֪��ICl���۵�Ϊ13.9�����е�Ϊ97.4������ˮ�⣬���ܷ�����Ӧ��ICl(l) + Cl2(g) == ICl3(l)����ͼ�мг�װ����ȥ��
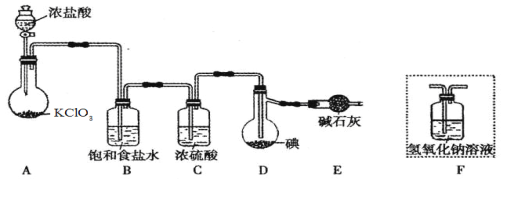
��1��װ��A�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��װ��B�������� ��������װ��F����װ��E������ ��
��3�����Ƶõ�ICl����������ICl3���ʣ��ᴿ�ķ����� (���ţ���
A.���� B.�����ᾧ C.���� D.��Һ
��4����ICl�ı�������Һ�ⶨij��֬�IJ����Ͷȡ�������������ʵ�飬ʵ��������йط�ӦΪ��
��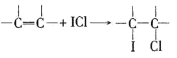
��ICl+KI=I2+KCl ��I2+2Na2S2O3=2NaI+Na2S4O6
ʵ��1:��5.00g����֬��Ʒ�������Ȼ�̼���γ�100mL��Һ������ȡ��ʮ��֮һ������20mLijICl�ı�������Һ(����������ַ�Ӧ������������KI��Һ�����ɵĵⵥ����a mol/L��Na2S2O3 ����Һ�ζ�����ƽ��ʵ�飬������ĵ�Na2S2O3��Һ��ƽ�����ΪV1mL��
ʵ��2(�հ�ʵ�飩��������֬��Ʒ�������������衢�����Լ���������ʵ��1��ȫ��ͬ��������ĵ�Na2S2O3��Һ��ƽ�����ΪV2mL��
���ζ������п��� ��ָʾ����
���ζ���������Ҫ����������ᵼ��V1 (�ƫ��ƫС����
��5.00g����֬��Ʒ�����ĵ�ICl�����ʵ���Ϊ mol���ɴ����ݾ����㼴����ø���֬�IJ����Ͷȡ�
���𰸡���1��KClO3+6HCl = KCl+3Cl2��+3H2O����2����ȥ�����е��Ȼ��⡣װ��F�е�ˮ���������װ��D�У�ʹIClˮ������3��C����4����������Һ�� ��ƫС����5a��V2-V1����10-3��
��������
�����������1��Aװ�ò�����������˷�Ӧ����ʽΪ��KClO3+6HCl = KCl+3Cl2��+3H2O��
��2��Aװ�ò��������к���ˮ������HCl����˱���ʳ��ˮ�����ó�ȥHCl����ΪICl��ˮ�⣬��˷�ֹˮ�����Ľ��룬��ʯ�ҵ����÷�ֹ������ˮ��������Dװ�ã�������F����E��
��3�����ݷ�Ӧ����ʽ��ICl��ICl3����Һ�壬�ǻ��ܵ�����Һ�壬��˲����������з��룬��ѡ��C��ȷ��
��4��������ʵ�飬�ⵥ�ʲμӷ�Ӧ�����õ������ⵥ�ʱ���������õ�����Һ��ָʾ����������������ܳ�ֻ�ϣ����ĵ���Һ�������С�������ݷ�Ӧ����ʽ�������Ĺ�ϵʽΪ��ICl��I2��2Na2S2O3��ʵ��2�ó���n(ICl)=V2��10��3��a/2mol��ʵ��1������֬��Ʒ��Ӧ��ʣ��ICl�����ʵ���ΪV1��10��3��a/2mol���������֬��ӦICl�����ʵ���Ϊ5a��V2-V1����10-3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���±���A��B��C��D��E�����л�����й���Ϣ��
A | B | C | D | E |
����һ��������ʹ������Ȼ�̼��Һ��ɫ ������ģ��Ϊ��
������ˮ��һ�������·�Ӧ����C | ����C��H����Ԫ����� �����ģ��Ϊ��
| �������Ʒ�Ӧ����������NaOH��Һ��Ӧ�� ������E��Ӧ������Է�������Ϊ100���� | ����C��H��Br����Ԫ����ɣ� ����Է�������Ϊ109 | ����C��H��O����Ԫ����ɣ� �����ģ��Ϊ��
|
���ݱ�����Ϣ�ش��������⣺
��1��д��Aʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ����ʽ��________________________��
��2��A�����������ӳɷ�Ӧ�����ɷ���F��F��ͬϵ���ͨʽΪCnH2n��2����n ��________ʱ�������л��↑ʼ��ͬ���칹�塣
��3��B�ķ���ʽΪ________��д����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___ ��
��4��D��A�����Լ�����Ӧ����Ϊ____________________����Ӧ����Ϊ__________________��
��5��C��E��Ӧ��������Է�������Ϊ100������д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��