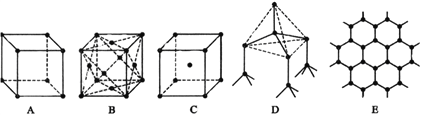
题目内容
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________,F2+的基态价电子排布式为____________。
(3)BA3- 离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为____________。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________;
【答案】 3 sp3 3d2 三角锥形 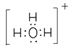 6 0.315(或0.223
6 0.315(或0.223![]() ) 水分子间存在氢键 2H2O+ + SO2 = 4H+ + SO42—
) 水分子间存在氢键 2H2O+ + SO2 = 4H+ + SO42—
【解析】(1)本题考查电负性规律、能级,A元素原子的核外电子数等于其电子层数,推出A为H,B元素基态原子有三个能级且各能级电子数相同,电子排布式为1s22s22p2,即B为C,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O,G为H2O2,H为H2O,因为原子序数依次增大,因此C为N,E元素原子的K、L层电子数之和等于其M、N层电子数之和,E为Ca,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同,推出F为Ti,B、C、D中电负性最大的是O,电子排布式为1s22s22p4,有3种能量不同的电子;(2)考查杂化类型的判断,G为H2O2,其结构式为H-O-O-H,O的价层电子对数为2+2=4,杂化轨道数等于价层电子对数,即H2O2中O的杂化类型为sp3;Ti2+的基态价电子应是次外层d能级,即为3d2;(3)考查空间构型、等电子体,BA3-为CH3-,C的价层电子对数为3+(4+1-3)/2=4,空间构型为三角锥形;与CH3-互为等电子体的阳离子为H3O+,其电子式为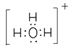 ;(4)考查晶胞,根据晶胞的结构,Ca2+的最近且等距的O2-有6个;K与O最近的距离是面对角线的一半,即为
;(4)考查晶胞,根据晶胞的结构,Ca2+的最近且等距的O2-有6个;K与O最近的距离是面对角线的一半,即为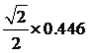 nm=0.223
nm=0.223![]() nm;(5)本题考查氢键和离子反应方程式的书写,H2O分子释放出一个电子,同时产生一种阳离子,即阳离子是H2O+,H2O分子间能够构成氢键,形成“网”的原因是水分子间存在氢键,H2O+具有强氧化性,SO2具有强还原性,H2O+把SO2氧化成H2SO4,因此离子反应方程式为:2H2O+ + SO2 = 4H+ + SO42-。
nm;(5)本题考查氢键和离子反应方程式的书写,H2O分子释放出一个电子,同时产生一种阳离子,即阳离子是H2O+,H2O分子间能够构成氢键,形成“网”的原因是水分子间存在氢键,H2O+具有强氧化性,SO2具有强还原性,H2O+把SO2氧化成H2SO4,因此离子反应方程式为:2H2O+ + SO2 = 4H+ + SO42-。

 能考试全能100分系列答案
能考试全能100分系列答案