题目内容
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题: 千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(1)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaCO3)②CaO③CO2④H2O⑤Ca(OH)2悬浊液⑥CaCO3 , 其中属于电解质的是(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是(填序号) ①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于氧化物(填“酸性”或“碱性”),用方程式说明你的理由 .
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图: 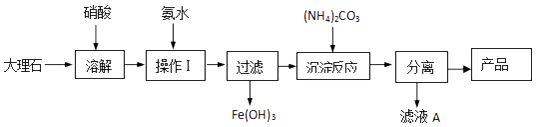 溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
溶解大理石时,用硝酸而不用硫酸的原因是 , “滤液A”中除H+离子外,还含有的阳离子是;检验该阳离予的实验操作是 .
【答案】
(1)②④⑥
(2)⑤
(3)碱性;CaO+2HCl=CaCl2+H2O
(4)硫酸钙微溶于水;NH4+;取少量滤液A与烧碱溶液在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,若试纸变蓝,则可证明
【解析】解:(1)①石灰石(主要成分CaCO3)是混合物,不是电解质; ②CaO 是熔融状态下能导电的化合物,属于电解质;③CO2 本身不能发生电离,是非电解质;④H2O 能发生电离,是电解质;⑤Ca(OH)2悬浊液是混合物,不是电解质;⑥CaCO3是熔融状态下能导电的化合物,属于电解质;所以答案是:②④⑥;(2)①从海水中提取镁的原料:海水、石灰乳,正确,②制硅酸盐水泥的原料:石灰石和黏土,正确,③制普通玻璃的原料:石英砂、石灰石、纯碱等,正确,④制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,正确,⑤生产陶瓷的原料是粘土,错误;所以答案是:⑤;(3)生石灰可与盐酸发生反应CaO+2HCl=CaCl2+H2O,根据碱性氧化物的概念属于碱性氧化物;所以答案是:碱性;CaO+2HCl=CaCl2+H2O;(4)溶解大理石时,用硝酸而不用硫酸的原因是硫酸钙微溶于水;滤液A”中除H+离子外,还含有的阳离子是铵根离子,检验铵根离子的方法为:取少量滤液A与烧碱溶液在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,试纸变蓝说明溶液中有铵根离子;所以答案是:硫酸钙微溶于水;NH4+;取少量滤液A与烧碱溶液在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,若试纸变蓝,则可证明.

【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。




