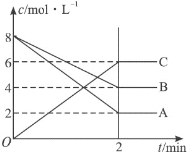
题目内容
【题目】如图为原电池装置,下列叙述正确的是( )
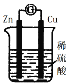
A.锌片溶解
B.锌片为正极
C.铜片质量减少
D.该装置将电能转化为化学能
【答案】A
【解析】
A、原电池中锌做负极失电子生成锌离子;
B、装置图为原电池,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应;
C、溶液中氢离子在铜电极上得到电子生成氢气,溶液中氢离子浓度减小,铜片的质量不变;
D、原电池是将化学能转化为电能的装置。
A、原电池中锌做负极失电子生成锌离子,负极电极反应为:Zn-2e-=Zn2+,故A正确;
B、分析装置图可知,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应,故B错误;
C、溶液中氢离子在铜电极上得到电子生成氢气,铜片的质量不变,故C错误;
D、原电池是将化学能转化为电能的装置,故D错误;
故选:A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目