题目内容
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
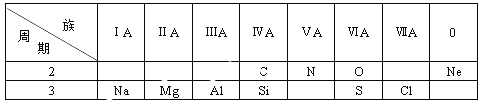
(1)金属性最强的元素是___________;
(2)最外层电子数为8的原子是___________;
(3) O和S二者原子半径较大的是___________;
(4)可用于制造光导纤维的氧化物是___________;
(5)CH4和SiH4二者热稳定性较强的是___________;
(6)MgO和Al2O3中,能与强碱溶液反应的是_____________;
(7)NaOH和Mg(OH)2中,碱性较弱的是___________;
(8)NO在空气中会变成红棕色的NO2,写出该反应的化学方程式___________;
(9)HClO4中氯元素的化合价是______;1mol HClO4含有_________mol O。
【答案】Na Ne S SiO2 CH4 Al2O3 Mg(OH)2 2NO+O2===2NO2 +7 4
【解析】
(1)同周期从左向右金属性减弱,同主族从上到下金属性增强,则上述元素中金属性最强的元素是Na(或钠);
(2)Ne原子的最外层电子数是8;
(3)同主族从上到下原子半径变大, O和S二者原子半径较大的是S;
(4)二氧化硅对光具有良好的全反射作用,可用于制造光导纤维的氧化物是SiO2;
(5)非金属性C大于Si,则CH4和SiH4二者热稳定性较强的是CH4;
(6) Al2O3具有两性,MgO和Al2O3中,能与强碱溶液反应的是Al2O3;
(7)同周期从左向右金属性减弱,最高价氧化物对应水化物的碱性减弱,NaOH和Mg(OH)2中,碱性较弱的是Mg(OH)2;
(8)NO在空气中会变成红棕色的NO2,该反应的化学方程式 2NO+O2=2NO2 ;
(9) 根据化合物中元素的化合价代数和为0,HClO4中氯元素的化合价是+7;1mol HClO4含有4mol O。