题目内容
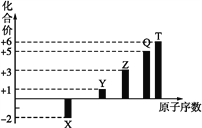
【题目】在一定体积的密闭容器内发生某气体体系反应,根据如图填空。
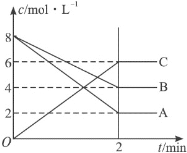
(1)反应物是___,生成物是____。
(2)在2min内A的平均反应速率为___mol·L-1·min-1。
(3)该反应的化学方程式是__![]() ___。
___。
(4)写出此反应的平衡常数表达式___(用物质A、B、C表示),增大压强,平衡向___(填“正”或“逆”)反应方向移动,K___(填“增大”、“减小”或“不变”)。
(5)转化率为已反应的物质的量与初始物质的量比值,B的转化率为___,若升高温度,B的转化率增加,则正反应是___(填“吸热”或“放热”)。
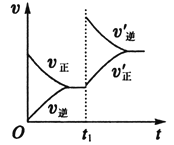
(6)2分钟后的某时刻(t1)改变某一条件使平衡移动,符合如图所示的条件是___。
【答案】AB C 3 3A+2B 3C ![]() 正 不变 50% 吸热 加入C
正 不变 50% 吸热 加入C
【解析】
(1)在反应中,反应物的浓度减小,生成物的浓度增大,由图中曲线变化可判断出反应物和生成物;
(2)在2 min内A由8mol/L降低为2mol/L,平均反应速率为![]() mol·L-1·min-1;
mol·L-1·min-1;
(3)上面已经确定了反应物和生成物,再利用浓度的变化量之比等于化学计量数之比,即A、B、C的化学计量数之比为6:4:6=3:2:3,从而得出该反应的化学方程式3A+2B![]() 3C;
3C;
(4)此反应的平衡常数表达式![]() ,增大压强,平衡向气体分子数减小的方向移动,K只受温度的影响,不受浓度变化的影响;
,增大压强,平衡向气体分子数减小的方向移动,K只受温度的影响,不受浓度变化的影响;
(5)转化率为已反应的物质的量与初始物质的量比值,B的转化率为![]() ,若升高温度,B的转化率增加,则正反应吸热;
,若升高温度,B的转化率增加,则正反应吸热;
(6)2分钟后的某时刻(t1)改变某一条件使平衡移动,因为在改变条件的瞬间,逆反应速率增大,正反应速率不变,则只能是改变生成物的浓度。
(1)在反应中,反应物的浓度减小,生成物的浓度增大,由图中曲线变化可判断出反应物为A和B,生成物为C;
(2)在2 min内A由8mol/L降低为2mol/L,平均反应速率为![]() mol·L-1·min-1;
mol·L-1·min-1;
(3)上面已经确定了反应物和生成物,再利用浓度的变化量之比等于化学计量数之比,即A、B、C的化学计量数之比为6:4:6=3:2:3,从而得出该反应的化学方程式3A+2B![]() 3C;
3C;
(4)此反应的平衡常数表达式![]() ,增大压强,平衡向气体分子数减小的方向移动,即向正反应方向移动,K只受温度的影响,不受浓度变化的影响,因为温度不变,所以K不变;
,增大压强,平衡向气体分子数减小的方向移动,即向正反应方向移动,K只受温度的影响,不受浓度变化的影响,因为温度不变,所以K不变;
(5)转化率为已反应的物质的量与初始物质的量比值,B的转化率为![]() ,若升高温度,B的转化率增加,则正反应吸热;
,若升高温度,B的转化率增加,则正反应吸热;
(6)2分钟后的某时刻(t1)改变某一条件使平衡移动,因为在改变条件的瞬间,逆反应速率增大,正反应速率不变,则只能是加入C,以增大生成物的浓度。

 寒假学与练系列答案
寒假学与练系列答案