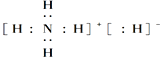��Ŀ����
����Ŀ���������������������ķ�����������ΪԽ��Խ��Ҫ�Ļ��������������⡣������Ҫ�ɶ�������������Ϳ������������������ɡ�
(1)��������β���������γɵ�ԭ��֮һ�������������������ѡ���Դ����������лӷ�������C3H6����ԭβ���е�NO���壬��д���ù��̵Ļ�ѧ����ʽ��__________
(2)���˶������ҹ�������ú��ů�������ķ���Ҳ����������Ҫ��Դ֮һ�����о����ֽ�ú̿��O2/CO2��������ȼ�գ������ܹ�����ȼúʱNO���ŷţ���Ҫ��ӦΪ��
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H
N2(g)+2CO2(g) ��H
���� N2(g)+O2(g)![]() 2NO(g) ��H1= ��180.5 kJmol-1
2NO(g) ��H1= ��180.5 kJmol-1
�� CO(g)![]() C(s)+1/2O2(g) ��H2= ��110.5 kJmol-1
C(s)+1/2O2(g) ��H2= ��110.5 kJmol-1
�� C (s)+O2(g)![]() CO2(g) ��H3= ��393.5 kJmol-1
CO2(g) ��H3= ��393.5 kJmol-1
����H=_____________kJmol-1��
(3)ȼúβ���е�SO2��NaOH��Һ�����γ�NaHSO3��Һ����pHΪ4~7֮��ʱ��⣬��Ԫ����Ǧ�����ϱ���ԭΪNa2S2O4��Na2S2O4�׳Ʊ��շۣ��㷺Ӧ����Ⱦ�ϡ�ӡȾ����ֽ��ʳƷ��ҵ�Լ�ҽѧ�ϡ����ּ���������ĵ绯ѧ������֮һ����д���õ�ⷴӦ�������ĵ缫����ʽ��______________________________________��
(4)SO2�����������������Ͻ��д���������ȡ�����������泥�����SO2�����������ķ�ӦΪ��2SO2(g) +O2(g)![]() 2SO3(g)������T1�桢0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2(����n(SO2):n(O2)=2:1)�������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��
2SO3(g)������T1�桢0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2(����n(SO2):n(O2)=2:1)�������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��
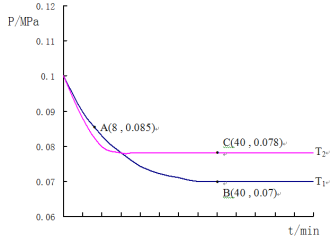
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K=__________________��
��ͼ��A��ʱ��SO2��ת����Ϊ________________
�ۼ���SO2��������Ӧ��ͼ��B���ѹǿƽ�ⳣ��K��_______________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)
������T2�棬�����������������²��ѹǿ�ı仯������ͼ��ʾ����T1____T2(����>������<������=��)������C�������Ӧ����vc(��)��A����淴Ӧ����vA(��)�Ĵ�С��ϵΪvc(��) ____vA(��) (����>������<������=��)��
���𰸡�2C3H6+18NO=6CO2+6H2O+9N2 ��746.5kJmol��1 2HSO3��+2H++2e��=S2O42��+2H2O�� ![]() 45% 24300��MPa����1 �� ��
45% 24300��MPa����1 �� ��
��������
��2�����ݸ�˹������Ӧ�ȣ�
��4���ڢ���������ʽ������ת���ʺ�ƽ�ⳣ����
���ȹ���ƽ�¶ȸߣ��ﵽƽ������ʱ��̣��¶�Խ�߷�Ӧ����Խ��
��1��C3H6����ԭβ���е�NO���壬���Եõ��������嵪���Ͷ�����̼����2C3H6+18NO=6CO2+6H2O+9N2��
��2�����ڡ�2+�ۡ�2�����õ�2NO��g��+2CO��g��N2��g��+2CO2��g������Ӧ���ʱ�=2��+110.5kJmol��1��+2����393.5kJmol��1������180.5kJmol��1��=��746.5kJmol��1���ʴ�Ϊ����746.5kJmol��1��
��3����ⷴӦ�������Ϸ����õ��ӵĻ�ԭ��Ӧ��2HSO3��+2H++2e��=S2O42��+2H2O���ʴ�Ϊ��2HSO3��+2H++2e��=S2O42��+2H2O��
��4����2SO2��g��+O2��g��2SO3����Ӧ��ƽ�ⳣ��K=![]() ��
��
�����ݻ�ѧ������ʽ���㣬�������������ʵ���Ϊx��
2SO2��g��+O2��g��![]() 2SO3
2SO3
��ʼ����mol�� 2a a 0
�仯����mol�� 2x x 2x
ƽ������mol��2a��2x a��x 2x
ͼ��A��ʱ���������ʵ���0.085����![]() ��
��
x=0.45a
SO2��ת����=![]() ��
��
��ͼ��B�㣬���ݻ�ѧ������ʽ���㣬�������������ʵ���Ϊy��
2SO2��g��+O2��g��![]() 2SO3
2SO3
��ʼ����mol�� 2a a 0
�仯����mol�� 2y y 2y
ƽ������mol��2a��2y a��y 2y
B���������ʵ���Ϊ 0.007����![]() ��y=0.9a��
��y=0.9a��
ƽ�ⳣ��K=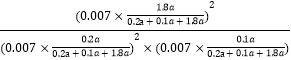 =24300(MPa)��1��
=24300(MPa)��1��
��ͼ�������֪���ȹ���ƽ�¶ȸ���T1��T2��C����ƽ��״̬��A�㷴Ӧδ�ﵽƽ��״̬������C�������Ӧ����vC��������A����淴Ӧ����vA���棩�Ĵ�С��ϵΪvC��������vA���棩

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ͭ��������������Ӧ�ù㷺��ij�������ú��������ķ�ͭ��Ϊԭ�������������������£�
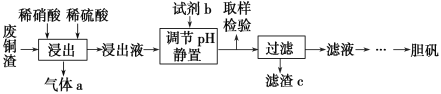
��֪�����������������pH���±���ʾ��
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
��ʼ���� | 4.2 | 6.5 | 1.5 |
��ȫ���� | 6.7 | 9.7 | 3.7 |
(1)д������ʱͭ��ϡ���ᡢϡ���ᷴӦ��������ͭ�Ļ�ѧ����ʽ��________________��
(2)ȡ��������Ϊ��ȷ��Fe3���Ƿ��������ļ��鷽����__________________________��
(3)�Լ�b��____________������c��______________(��д��ѧʽ)��
(4)����a���Ա�ѭ�����ã��û�ѧ����ʽ��ʾ����a��ѭ�����õ�ԭ��Ϊ2NO��O2===2NO2����__________________��
(5)һ���¶��£�����ͭ���ȷֽ�����CuO��SO2���塢SO3�����O2���壬��n(SO3)��n(SO2)��1��2��д������ͭ���ȷֽ�Ļ�ѧ����ʽ��________________��
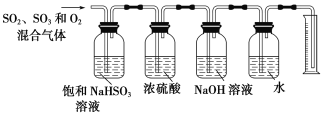
(6)ijͬѧ���������ͼ��ʾ��ʵ��װ�÷ֱ�ⶨ���ɵ�SO2��SO3�����������O2����������������в�����֮������˵�����ɣ�______________��